
| A. | 原子半径:X>R>Z>Y | |
| B. | 最高价氧化物对应水化物的酸性:R>Z>W | |
| C. | 对应单质的沸点:X>Z>Y | |
| D. | RY2、WY2通入BaCl2溶液中均无白色沉淀生成 |
分析 X、Y、Z、W、R属于短周期主族元素,X在短周期主族元素中原子半径最大,则X为Na;
Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,则m+n=8,Y原子有2个电子层,故n=2,则m=8-2=6,可推知Y为O元素,Z原子M层电子数为6-2=4,故Z为Si;
W元素与Z元素同主族,则W为C元素;
R元素原子与Y元素原子的核外电子数之比为2:1,R元素原子核外电子数为16,故R为S元素,据此解答.
解答 解:X、Y、Z、W、R属于短周期主族元素,X在短周期主族元素中原子半径最大,则X为Na;Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,则m+n=8,Y原子有2个电子层,故n=2,则m=8-2=6,可推知Y为O元素,Z原子M层电子数为6-2=4,故Z为Si;W元素与Z元素同主族,则W为C元素;R元素原子与Y元素原子的核外电子数之比为2:1,R元素原子核外电子数为16,故R为S元素.
A.同周期自左而右原子半径减小、电子层越多原子半径越大,故原子半径X(Na)>Z(Si)>R(S)>W(C),故A错误;
B.非金属性S>C>Si,故最高价含氧酸的酸性:硫酸>碳酸>硅酸,故B错误;
C.常温下,氧气为气体,Na、Si为固体,氧气沸点最低,而硅属于原子晶体,沸点很高,Na的熔点较低,故沸点硅>钠>氧气,故C错误;
D.亚硫酸、碳酸的酸性均小于盐酸,故SO2、CO2通入BaCl2溶液中均无白色沉淀生成,故D正确;
故选D.
点评 本题考查结构性质位置关系应用,关键是根据核外电子排布推断元素,注意对元素周期律及物质熔沸点比较的理解掌握,知道原子半径大小比较方法.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
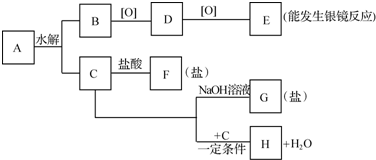
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3a}{2B}$mol/L | B. | $\frac{a}{27B}$mol/L | C. | $\frac{a}{18B}$mol/L | D. | $\frac{2a}{81B}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol C(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有σ键的数目为5NA | |
| C. | 含0.2moi H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
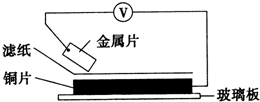 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( ) | 金属 | 电子流动方向 | 电压(V) |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | E→Cu | +0.30 |
| A. | 金属乙能从硫酸铜溶液中置换出铜 | |
| B. | 甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀 | |
| C. | 在四种金属中乙的还原性最强 | |
| D. | 甲、丁若形成原电池时,甲为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
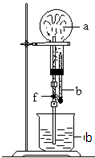 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )| a(干燥气体) | b(液体) | |
| ① | N02 | 水 |
| ② | CO2 | 4mol•L-1NaOH溶液 |
| ③ | C12 | 饱和食盐水 |
| ④ | NH3 | l mol•L-1盐酸 |
| A. | ①和② | B. | ③和④ | C. | ①和③ | D. | ②和④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com