
【题目】下列事实不能用化学平衡移动原理解释的是( )
A.滴加少量![]() 溶液可以加快Zn与稀
溶液可以加快Zn与稀![]() 反应的速率
反应的速率
B.高压比常压更有利于![]() 转化为
转化为![]()
C.蒸干![]() 溶液无法得到无水
溶液无法得到无水![]()
D.新制氯水长时间放置颜色变浅
【答案】A
【解析】
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动。使用勒夏特列原理时,该过程必须是可逆过程,否则勒夏特列原理不适用。
A.滴加少量CuSO4溶液,少量的锌与铜离子反应生成铜,铜与锌和硫酸构成原电池加快反应速率,不能用化学平衡移动原理解释;
B.SO2转化为SO3的反应为气体体积缩小的可逆反应,增大压强平衡正向移动,能用勒夏特列原理解释;
C.AlCl3溶液中Al3+水解生成Al(OH)3,加热时由于HCl的挥发,促进Al3+的水解,最终得到Al(OH)3,不能得到AlCl3,能用平衡移动原理解释;
D.新制氯水中存在Cl2与水生成HCl和HClO的可逆反应,放置数天后HClO分解成HCl和O2,c(HClO)减小,促进氯气与水的反应,氯水的颜色变浅,能用化学平衡移动原理解释;
故答案为A。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】橡皮筋在拉伸和收缩状态时结构如图。在其拉伸过程中有放热现象。25℃、101 kPa时,下列过程的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是()

A. CaCO3=CaO+CO2↑ B. NaOH的溶解
C. 2H2+O2=2H2O D. Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物X的结构简式如图所示,下列有关叙述不正确的是( )
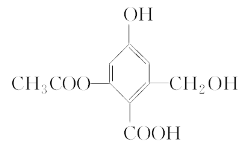
A. 1 mol X最多可与3 mol H2发生加成反应
B. X在一定条件下能与FeCl3溶液发生显色反应
C. X在一定条件下能发生消去反应和酯化反应
D. 1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗Na、NaOH、NaHCO3的物质的量分别为3 mol、4 mol、1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,A和E属同一族,它们原子的最外层电子排布式为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,C是________,D是________,E是________。
(2)由这5种元素组成的一种化合物是(写化学式)______________________。写出该物质的一种主要用途:_________________________________________
(3)写出C元素基态原子的电子排布式:_______________________________。
(4)用电子排布图表示D元素原子的最外层电子排布:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500 mL NaOH溶液完全吸收,生成NaNO2和NaNO3两种盐溶液,其中NaNO3的物质的量为0.2mol,则NaOH的浓度为 ( )
A.1.8mol/LB.2mol/LC.2.4 mol/LD.3.6 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将两种不同浓度的某一元酸HA分别与NaOH溶液等体积混合(混合后溶液体积等于混合前两溶液体积之和),测得反应后溶液的pH如表所示。下列判断错误的是( )
实验编号 | 起始浓度(mol/L) | 反应后溶液的pH | |
c(HA) | c(NaOH) | ||
① | 0.10 | 0.10 | 9 |
② | x | 0.05 | 7 |
A.HA是弱酸
B.![]()
C.实验①所得溶液中:![]() mol/L
mol/L
D.实验②所得溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化趋势如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期中金属性最强的元素;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是( )

A.对应气态氢化物的稳定性:Y>W
B.对应简单离子的半径:W>Z
C.化合物XZW中既含离子键也含共价键
D.Y的氧化物能与Z的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,能用勒夏特列原理解释的是( )
A. 由H2、I2、HI三种气体组成的平衡体系加压后颜色变深
B. 对2SO2+O2![]() 2SO3 △H<0的反应,使用催化剂可加快反应的速率
2SO3 △H<0的反应,使用催化剂可加快反应的速率
C. 实验室可用浓氨水和氢氧化钠固体快速制取氨气
D. N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,500 ℃左右比室温更有利于合成NH3
2NH3(g) ΔH<0,500 ℃左右比室温更有利于合成NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)写出K2表达式:____。
(2)推导反应CO2(气)+H2(气)![]() CO(气)+H2O(气)的平衡常数K与K1、K2的关系式:__,判断该反应是__反应(填“吸热”或“放热”)。
CO(气)+H2O(气)的平衡常数K与K1、K2的关系式:__,判断该反应是__反应(填“吸热”或“放热”)。
(3)在体积为10L的密闭容器中,加入一定量的CO2和H2(气),在1173K时发生反应CO2(气)+H2(气)![]() CO(气)+H2O(气)并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
CO(气)+H2O(气)并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
时间/min | CO2(mol/L) | H2(mol/L) | CO(mol/L) | H2O(mol/L) |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.2740 | 0.0260 | 0.0260 | |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率是:_____。
②在0~5min之间,达平衡时CO2的转化率为____。
③第6min时,平衡向____方向(填“正反应”或“逆反应”)移动,可能的原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com