
下列关于化学反应的自发性叙述中正确的是 ( )
A.焓变小于0而熵变大于0的反应肯定是自发的
B.焓变和熵变都小于0的反应肯定是自发的
C.焓变和熵变都大于0的反应肯定是自发的
D.熵变小于0而焓变大于0的反应肯定是自发的
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关氧化还原反应的叙述正确的是
A. 氧化还原反应的本质是元素化合价发生变化
B. 物质所含元素化合价降低的反应是氧化反应
C. 置换反应一定属于氧化还原反应
D. 化合反应和分解反应不可能是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应4NH3(g) + 5O2(g) 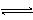 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
用蒸馏水稀释1 mol·L-1醋酸时,始终保持增大趋势的是 ( )
A、溶液中的c(CH3COO-) B、溶液中的c(H+)
C、溶液中的c(CH3COOH) D、溶液中的c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤II:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的
体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂颜色由 色。
(2)滴定结果如下表所示:
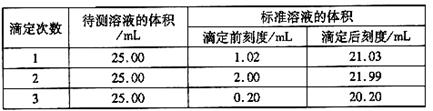
若NaOH标准溶液的浓度为0.1050mol·L-1则该样品中氮的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.ΔH的大小与热化学方程式的化学计量数无关
B.生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0
C.在化学反应过程中,发生物质变化的同时不一定发生能量变化
D.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.(12分)现有下列物质:①HNO3 ②冰醋酸 ③氨水 ④Al(OH)3 ⑤NaHCO3(s) ⑥Cu ⑦氯水 ⑧CaCO3 ⑨H2CO3 ⑩盐酸
(1)上述物质中属于强电解质的有________,属于弱电解质的有________。
(2)写出下列物质的电离方程式:
②、______________________;④、______________________;
⑤、______________________;⑨、 。
Ⅱ.(4分)化学反应4A(s)+3B(g)  2C(g)+D(g)经10 minC的浓度增加0.6 mol/L。
2C(g)+D(g)经10 minC的浓度增加0.6 mol/L。
(1)用B表示的反应速率是________ 。
(2)分别用B、C、D表示的反应速率其比值是________ 。
III.(8分)完成下列问题:
(1)汽油的重要成分是辛烷(C8H18),1molC8H18(l)在与O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518KJ热量,该反应热化学方程式为:
。
(2)已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:
C(金刚石、s)+O2(g)=CO2(g) △H=-395.41kJ/mol
C(石墨、s)+O2(g)=CO2(g) △H=-393.51kJ/mol
则石墨转化为金刚石的热化学方程式为:________ ,由此看来金刚石的稳定性 (填“大于”、“小于”、“不确定”)石墨的稳定性。
(3)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应。已知:
N2(g) +2O2(g) =2NO2(g) ⊿H=67.7kJ/mol
N2H4(g) +O2(g) = N2(g) +2H2O(g) ⊿H=-534kJ/mol
H2 O (l) =H2O (g) ΔH=44 kJ/mol
1molN2H4(g)与 NO2(g)完全反应生成N2和H2 O (l)时放出热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;
③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
A.②④③⑤① B.③②④①⑤ C.③④②⑤① D.②④⑤③①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com