





| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ͭ��Һ�м������Ba��OH��2��Һ��Ba2++SO42-=BaSO4�� |
| B��A1Cl3��Һ�мӹ�����NaOH��Һ��Al3++3OH-=Al��OH��3�� |
| C��ͭ����������Һ��Ӧ��Cu+Ag+=Cu2++Ag |
| D��̼�����������ᷴӦ��CaCO3+2H+=Ca2++CO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ��ʼ���ʵ��� | �� | �� | �� |
| n��H2O��/mol | 0.10 | 0.20 | 0.20 |
| n��CO��/mol | 0.10 | 0.10 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��������������˵����ȷ����
��������������˵����ȷ����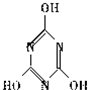 ������������ɿ���������������ͨ���ӳɷ�Ӧ�õ��Ļ�״���ӣ�������Ľṹʽ��
������������ɿ���������������ͨ���ӳɷ�Ӧ�õ��Ļ�״���ӣ�������Ľṹʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 A��F����ѧ�������ʣ�����B��D��F��Ϊ���ʣ����ǵ��ת����ϵ��ͼ��ʾ��
A��F����ѧ�������ʣ�����B��D��F��Ϊ���ʣ����ǵ��ת����ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | |
| A | ��֪[Cu��H2O��4]2+������+4Cl-[CuCl4]2-���̣�+4H2O������Ũ����ʹ��ɫCuCl2��Һ����ɫת�� | 0.1mol?L-���Ȼ����Һ��0.05mol?L-������������Һ�������Ϻ����Һ������Ũ�ȣ� c��Cl-����c��NH4+����c��Na+����c��OH-�� |
| B | 0.1mol?L-1������Һ������Ũ�ȹ�ϵ�� c��Na+��=c��S2-��+c��HS-��+c��H2S�� |
����������μ�ˮ������Һ�ĵ����ԡ�����ĵ���ȡ�pH����������С |
| C | Ϊ�����KMnO4��Һ�����������������Ὣ���ữ | �����¶��ܼӿ췴Ӧ���ʵ���Ҫԭ���������˷�Ӧ������л���ӵİٷ��� |
| D | �����´�����ӿ��ܴ�����pH��7�ļ�����Һ�� | Ҫ�Ƶýϴ���FeS��������FeCl2��Һ�м�����Լ�������Na2S��NH4��2S |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ڱ�״���£�22.4L NH3���е�ԭ����ΪNA |
| B��5.6g��������������ȫ��Ӧ��ʧȥ�ĵ�����Ϊ0.2NA |
| C��1L 0.1mol/L AlCl3��Һ�У���Al3+�����ʵ���Ϊ0.1NA |
| D�����Ϊ44.8L �ĵ��������ķ��Ӹ���2NA�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com