
(17分)金属镍具有优良的物理和化学特性,是高技术产业的重要原料。
(1)羰基法提纯镍涉及的反应为:Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
①当温度升高时, 减小,则?H 0(填“>”或“<”)。
减小,则?H 0(填“>”或“<”)。
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填代号)。

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0—3s内的平均反应速率v(CO)=____mol 。
。
③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为____________________(写出一条措施即可)。
(2)以NiS04溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼,下列说法正确的是____________(填代号)。(已知氧化性: )
)
a.电解过程中,化学能转化为电能
b.粗镍作阳极,发生还原反应
c.利用阳极泥可回收Cu、Pt、Au等金属
d.粗镍精炼时通过的电量与阴极析出镍的质量成正比
(3)工业上用硫化镍(NiS)作为电极材料冶炼镍。电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,镍元素以Ni2+形态进入电解液中,如图所示。硫化镍与电源的____________(填“正极”或“负极”)相接。写出阳极的电极反应式________________。

(1)①<;②bd;不变;0.8mol﹒L—1﹒S—1。③增大CO的浓度或增大压强。(2)cd;
(3) 正极;NiS—2e- Ni2++S。
Ni2++S。
【解析】
试题分析:(1)①对于反应:Ni(s)+4CO(g) Ni(CO)4(g),当温度升高时,
Ni(CO)4(g),当温度升高时,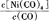 减小,说明平衡逆向移动,升高温度平衡向吸热反应方向移动,则该反应的逆向吸热,正向为放热反应,?H<0;②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,a.随着反应的进行,容器内气体的质量增大,物质的量减小,等压条件下容器体积减小,密度逐渐增大,达平衡时密度不变,与图像不符,错误;b.随着反应的减小,反应物的浓度逐渐减小,正反应速率逐渐减小,达平衡时正反应速率不变,与图像符合,正确;c.?H不随反应的进行而变化,不能作为平衡标志,错误;d.CO的转化率随反应的进行不断增大,达平衡时CO的转化率不变,与图像相符,正确,选bd;若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,影响平衡常数的外界因素为温度,温度不变,平衡常数不变;根据公式v=△n/V△t将题给数据代入计算得v(Ni(CO)4)=0.2mol﹒L—1﹒S—1,则0—3s内的平均反应速率v(CO)=0.8mol﹒L—1﹒S—1。③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为增大CO的浓度或增大压强。(2)迁移教材知识铜的电解精炼作答。以NiSO4溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼, a.电解过程中,电能转化为化学能,错误;b.粗镍作阳极,发生氧化反应,错误;c.精炼过程中比镍活泼的金属Fe、Zn以离子形式进入电解质溶液,活泼性比镍弱的金属Cu、Pt、Au进入阳极泥,正确;d.粗镍精炼时通过的电量与阴极析出镍的质量成正比,正确,选cd;(3) 根据题意知,电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,硫元素的化合价由—2价升高为0价,发生氧化反应,作电解池的阳极,与电源的正极相接。阳极的电极反应式为NiS—2e-
减小,说明平衡逆向移动,升高温度平衡向吸热反应方向移动,则该反应的逆向吸热,正向为放热反应,?H<0;②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,a.随着反应的进行,容器内气体的质量增大,物质的量减小,等压条件下容器体积减小,密度逐渐增大,达平衡时密度不变,与图像不符,错误;b.随着反应的减小,反应物的浓度逐渐减小,正反应速率逐渐减小,达平衡时正反应速率不变,与图像符合,正确;c.?H不随反应的进行而变化,不能作为平衡标志,错误;d.CO的转化率随反应的进行不断增大,达平衡时CO的转化率不变,与图像相符,正确,选bd;若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,影响平衡常数的外界因素为温度,温度不变,平衡常数不变;根据公式v=△n/V△t将题给数据代入计算得v(Ni(CO)4)=0.2mol﹒L—1﹒S—1,则0—3s内的平均反应速率v(CO)=0.8mol﹒L—1﹒S—1。③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为增大CO的浓度或增大压强。(2)迁移教材知识铜的电解精炼作答。以NiSO4溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼, a.电解过程中,电能转化为化学能,错误;b.粗镍作阳极,发生氧化反应,错误;c.精炼过程中比镍活泼的金属Fe、Zn以离子形式进入电解质溶液,活泼性比镍弱的金属Cu、Pt、Au进入阳极泥,正确;d.粗镍精炼时通过的电量与阴极析出镍的质量成正比,正确,选cd;(3) 根据题意知,电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,硫元素的化合价由—2价升高为0价,发生氧化反应,作电解池的阳极,与电源的正极相接。阳极的电极反应式为NiS—2e- Ni2++S。
Ni2++S。
考点:考查化学反应速率、化学平衡的影响因素及计算,电解原理的应用及电极反应式的书写。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高二化学试卷(解析版) 题型:选择题
下列物质属于芳香烃,但不是苯的同系物的是( )
①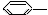 CH3 ②
CH3 ②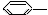 CH=CH2 ③
CH=CH2 ③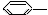 NO2
NO2
④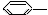 OH ⑤
OH ⑤ 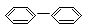 ⑥
⑥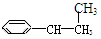
A.③④ B.②⑤ C.①②⑤⑥ D.②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省乳山市下学期期中考试高一化学试卷(解析版) 题型:选择题
已知某反应的能量变化如图所 示,下列说法正确的是
示,下列说法正确的是

A.该反应可用于表示烧碱与硫酸反应
B.该反应只有在加热条件下才能进行
C.反应物的总能量高于生成物的总能量
D.该反应可用于表示碳酸钙受热分解的反应
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三三模试卷理科综合化学试卷(解析版) 题型:填空题
(17分)运用化学反应原理研究碳的化合物具有重要意义。
(1)常温下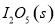 可用于检测CO,反应原理为:
可用于检测CO,反应原理为: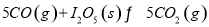
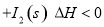 。向2L密闭容器中加入足量
。向2L密闭容器中加入足量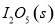 ,并通人1molCO,CO2的体积分数
,并通人1molCO,CO2的体积分数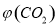 随时间的变化如下图所示。
随时间的变化如下图所示。
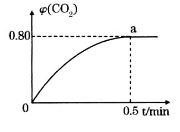
①0~0.5min内的平均反应速率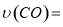 _____________。
_____________。
②保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是____________(填代号)。
a.生成I2的质量为原来的2倍
b.混合气体的平均摩尔质量不变
c.达到平衡的时间为原来的2倍
d.混合气体的密度不变
③反应达a点时,欲增大容器中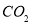 的体积分数
的体积分数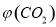 ,可采取的措施为____________。
,可采取的措施为____________。
(2)以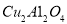 为催化剂,可以将
为催化剂,可以将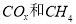 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。
①若该反应的原子利用率为100%,则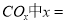 ______________。
______________。
②在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则 ________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)利用反应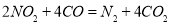 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三三模试卷理科综合化学试卷(解析版) 题型:选择题
下列与化学概念有关的说法正确的是
A.电解、电离的过程都需要消耗电能
B.元素的非金属性越强,对应单质的活泼性一定越强
C.有单质参加或生成的化学反应一定是氧化还原反应
D.只含共价键的物质不一定是共价化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:选择题
下列有关实验的叙述正确的是
A.酸式滴定管注入Na2CO3溶液之前应检查是否漏液
B.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
C.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
D.除去Fe(OH)3固体中少量:Mg(OH)2加入足量饱和FeCl3溶液,充分搅拌后过滤
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省下学期高二期末化学模拟试卷(解析版) 题型:填空题
(10分)按下面步骤由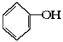 合成
合成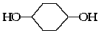 (部分试剂和反应条件已略去)。
(部分试剂和反应条件已略去)。

请回答下列问题:
(1)分别写出B、D的结构简式:B_________、D_________。
(2)反应①~⑦中属于消去反应的是 。(填数字序号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为:____________________。
(4)试写出C→D反应的化学方程式(注明反应条件) 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省东营市高三第二次模拟理科综合化学试卷(解析版) 题型:简答题
(12分)【化学-物质结构与性质】
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
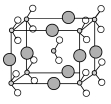
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省皖南八校高三第三次联考理综化学试卷(解析版) 题型:选择题
下列装置能达到实验目的是( )

A.用图①所示装置测定NaOH的浓度 B.用图②所示装置分馏少量石油
C.用图③所示装置在实验室制备收集氨气 D.用图④所示装置鉴别碳酸钠和碳酸氢钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com