
ͼ��-?�ֱ�����йط�Ӧ�е�һ�����ʣ����������¿հס�

��1���١��ܵĻ�ѧʽ�ֱ���______��______��
��2���õ���ʽ��ʾ�ڵ��γɹ���Ϊ ��
��3������ᷴӦ�Ļ�ѧ����ʽ��______������۵Ĵ��ڵķ����� ��
��4��MgҲ��������ϡ��Һ��Ӧ���ɢޣ�д����Ӧ�����ӷ���ʽ ��
��1����NH4��2CO3��NH4HCO3 O2
��2��
��3��C+4HNO3  4NO2��+CO2��+2H2O����ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ�����ֽ�����ɫ�������ɰ�����
4NO2��+CO2��+2H2O����ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ�����ֽ�����ɫ�������ɰ�����
��4��3Mg+8H++2NO3-=3Mg2++2NO��+4H2O
���������ɢ�+Mg����+�⣬�뵽��ѧ��ѧ�ĵ��ͷ�ӦCO2+2Mg=C+2MgO֪��ΪCO2Ϊͻ�ƿڣ��ɢ�+Na2O2����+�ݣ��Ң�ΪCO2���ƶ�֪�ܡ���ΪNa2CO3��O2���ɢ�+�� ��+
��+ ?�ƶ�֪��ΪO2���ΪNa2CO3����ΪNH3�����������Ƴ�����Ϊ��NH4��2CO3��NH4HCO3����ΪNO����ΪNO2����ΪHNO3����ΪC����ΪMgO����ΪH2O��
?�ƶ�֪��ΪO2���ΪNa2CO3����ΪNH3�����������Ƴ�����Ϊ��NH4��2CO3��NH4HCO3����ΪNO����ΪNO2����ΪHNO3����ΪC����ΪMgO����ΪH2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��13 ���ͣ�ѡ����
�����±���CuFeS2�ķ�Ӧ֮һΪ2CuFeS2+7O2=CuSO4+CuO+Fe2O3+3SO2�����й��ڸ÷�Ӧ��������ȷ����
A��CuFeS2����Ļ��ϼ�Ϊ-1
B��CuFeS2������ԭ��Ӧ
C��1 mol CuFeS2��ȫ��Ӧת��13 mol����
D��CuSO4��SO2��������������ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��11 ���ͣ�ѡ����
����˵��һ����ȷ���ǣ�NA��ʾ�����ӵ�������
A��������4.4gN2O���״����2.24LCH4������0.1NA������
B��78g�����أ�K����ȫת��Ϊ�������أ�KO2��ʱ��ת�Ƶ�����Ϊ4NA
C��0.1mol/Lϡ�����У�H+��ĿΪ0.1NA
D��60g�������辧���У���S��O����ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��10 ���ͣ�ѡ����
��ͼΪԪ�����ڱ������ڵ�һ����,Eԭ�ӵĵ��Ӳ���Ϊn������������Ϊ2n+1����������ȷ����
A |
| B | C |
|
| D | E |
A��C��E�⻯������ȶ��Ժͻ�ԭ�Ծ����μ���
B��A��B�γɵ������ӿ�����AB32�� A2B42��
C��AD2������ÿ��ԭ�ӵ�������Ϊ8���ӽṹ
D��A��D��E������������Ӧ��ˮ���������������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��10 ���ͣ�ѡ����
FeS��һ��Ũ�ȵ�HNO3��Ӧ������Fe(NO3)3��Fe2(SO4)3��NO2��N2O4��NO��H2O����NO2��N2O4��NO�����ʵ���֮��Ϊ1:1:1ʱ��ʵ�ʲμӷ�Ӧ��FeS��HNO3�����ʵ���֮��Ϊ
A.1:6
B.2:15
C.2:11
D.1:7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��1 ���ͣ�ѡ����
��ѧ��Դ�������Ӧ�������������С����й��ڻ�ѧ���������������ʶ����ȷ����
A����ú������Һ���ȷ��������������ȼ ��ȼ��Ч�ʵ���Ҫ��ʩ֮һ
��ȼ��Ч�ʵ���Ҫ��ʩ֮һ
B��CO2��CxHy��N2�Ⱦ����������ЧӦ������
C���Ҵ�����Ȼ����Һ��ʯ������������������Ϊȼ�ϵ�ص�ԭ�ϣ�������������Ϊ������ԭ��
D�������������ÿ�ȼ������̬����ˮ��������ڻ�����Դ��ȱ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ�� ���ͣ������
���Ĺ̶�������;��������̵�����Ȼ�̵���ҵ�̵����������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ���(��������Fe2O3��TiO2)������ˮ������Ӧ�����ɵ���Ҫ����ΪNH3����һ���о�NH3���������¶ȵĹ�ϵ������ʵ�����ݼ��±�(���ա�N2ѹ��1.0��105 Pa����Ӧʱ��1 h)��
T/K | 303 | 313 | 323 | 353 |
NH3������/(10��6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
��Ӧ�Ļ�ѧ����ʽ��2N2(g)��6H2O(l)  4NH3(g)��3O2(g)��H��a kJ��mol��1
4NH3(g)��3O2(g)��H��a kJ��mol��1
�ش��������⣺
(1)�˺ϳɷ�Ӧ��a________0����S________0��(�����������������)
(2)��֪��N2(g)��3H2(g)  2NH3(g)����H����92 .4 kJ��mol��1
2NH3(g)����H����92 .4 kJ��mol��1
2H2(g)��O2(g) ===2H2O(l)�� ��H ����571.6 kJ��mol��1
��2N2(g)��6H2O(l)===4NH3(g)��3O2 (g)����H��________kJ��mol��1
(3)��323 K��353 K�����������������ٵĿ���ԭ��_________________��
(4)��ҵ�ϳɰ��ķ�ӦΪN2(g)��3H2(g) 2NH3(g)����H����92 .4 kJ��mol��1 ���ֱ��о���T1��T2��T3(T1<T2<T3)�����¶��ºϳɰ����Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��N2����ʼ��ɱ�(��ʼʱN2�����ʵ�����Ϊ1 mol)��N2ƽ��ת���ʵĹ�ϵ����ش�
2NH3(g)����H����92 .4 kJ��mol��1 ���ֱ��о���T1��T2��T3(T1<T2<T3)�����¶��ºϳɰ����Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��N2����ʼ��ɱ�(��ʼʱN2�����ʵ�����Ϊ1 mol)��N2ƽ��ת���ʵĹ�ϵ����ش�

�������������¶��У�����X��Ӧ���¶���________��
��a��b��c����H2��ת������С����________�㡢ת����������________�㡣
�����ݻ�Ϊ1.0 L���ܱ������г���0.30 mol N2(g)��0.80 mol H2(g)����Ӧ��һ�������´ﵽƽ��ʱ��NH3�����ʵ�������(NH3�����ʵ����뷴Ӧ��ϵ���ܵ����ʵ���֮��)Ϊ4/7���������·�Ӧ2NH3(g)  N2(g)��3H2(g)��ƽ�ⳣ��Ϊ________ ��
N2(g)��3H2(g)��ƽ�ⳣ��Ϊ________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--�����ۺ�5 ���ͣ������
A��J���ճ������г��������ֽ����������ֽ�����NaOH���ԭ��أ�A��������F�����������嵥�ʣ������������µ�ת����ϵ�����ֲ��P������ȥ����

��ش��������⣺
��1��д����ԭ��ص��ܷ�Ӧ����ʽ_____________________��
��2��д���ڵĻ�ѧ����_________________��
��3������ʱpH=12��C��Һ�У����ʵ������������ʵ�������Ũ��֮��Ϊ ����д������ʽ��
��4��������J��������Ϊ�����������ÿ����1mol J�ų�Q kJ����������д��A��J��Ӧ���Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���ճ����и߶���ѧ��ĩģ��4������2��ѡ��4���ṹ���Ծ��������棩 ���ͣ������
��16�֣�����ұ����ҵ�г��õ����Ӽ�����̼���̿���Ҫ�ɷ�ΪMnCO3�����������������ܵ�̼�������ʣ�Ϊԭ�����������̵Ĺ����������£�
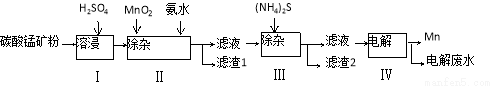
��֪25�棬�������ʵ��ܶȻ��������£�
���� | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1��10-13 | 3.0��10-16 | 5.0��10-16 | 1.0��10-11 | 5.0��10-22 | 1.0��10-22 |
��1��������У�MnCO3�����ᷴӦ�Ļ�ѧ����ʽ�� ��
��2��������У�MnO2�����������¿ɽ�Fe2+��������ΪFe3+����Ӧ�����ӷ���ʽ�� ���Ӱ�ˮ������Һ��pHΪ5.0-6.0���Գ�ȥFe3+��
��3��������У�����2����Ҫ�ɷ��� ��
��4��������У��� ���������������������Mn���缫��Ӧ����ʽΪ ��
��5������ķ�ˮ�л�����Mn2+������ʯ�������һ�������õ�Mn(OH)2���������˺�������Һ�м�������Na2S�����ж������������ж���������Ŀ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com