
| A. | 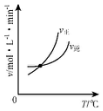 | B. | 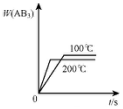 | C. | 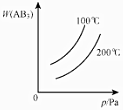 | D. | 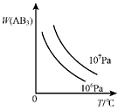 |
分析 对于可逆反应A2(g)+3B2(g)?2AB3(g)△H<0,正反应放热,升高温度正逆反应速率都增大,逆反应速率增大更快,化学向逆反应方向移动,增大压强,平衡向正反应方向移动,结合图象分析解答.
解答 解:A.升高温度,正逆反应速率都增大,平衡向逆反应方向移动,交叉点后,逆反应速率应该大于正反应速率,故A错误;
B.温度越高,反应速率越快,则到达平衡的时间越短,升高温度,平衡向逆反应方向移动,生成物含量减小,故B正确;
C.该反应是放热反应,升高温度,平衡向逆反应方向移动,则生成物的含量减小,一定温度下,压强越大,平衡向正反应方向移动,则生成物的含量增大,故C错误;
D.该反应是气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,所以生成物的含量增大而不是减小,故D错误;
故选B.
点评 本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”即可解答,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
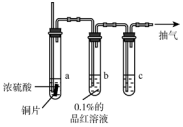 某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).
某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨常用作冷冻剂 | |
| B. | 常温下浓硫酸与浓硝酸均可用铁制容器储存 | |
| C. | 铵盐易受热分解,因此存放时氨态氮肥要密封保存,并放在阴凉通风处 | |
| D. | 活泼金属不能从稀盐酸中置换出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,水溶液是弱(填“强、弱”)酸,写出氢硫酸的电离方程式H2S?HS-+H+.其水溶液在空气中放置一段时间后会出现淡黄色的S沉淀现象,该反应的化学方程式是2H2S+O2=2S+2H2O,所以硫化氢水溶液不能长期放置.盛放硫化氢水溶液的试剂瓶壁上常有一些固体,可用CS2(填化学式)洗涤除去.
,水溶液是弱(填“强、弱”)酸,写出氢硫酸的电离方程式H2S?HS-+H+.其水溶液在空气中放置一段时间后会出现淡黄色的S沉淀现象,该反应的化学方程式是2H2S+O2=2S+2H2O,所以硫化氢水溶液不能长期放置.盛放硫化氢水溶液的试剂瓶壁上常有一些固体,可用CS2(填化学式)洗涤除去.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com