
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
有200mL MgCl2 和 AlCl3 的混合溶液,其中c(Mg2+)= 0.2 mol/L,c(Cl-)= 1.3 mol/L,要使Mg2+全部转化为沉淀分离出,至少需要4mol/L NaOH 溶液的体积是
A. 40mL B. 72 mL C. 80 mL D. 128Ml
查看答案和解析>>
科目:高中化学 来源: 题型:
为测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,称取一定质量的样品,甲同学利用图I所示装置测量产生CO2的体积,乙同学利用图II所示装置通过干燥管的增重测量产生CO2的质量,已知所用稀硫酸均足量。

(l)盛放稀硫酸的仪器名称为 。
(2)试剂X为 ;试剂Y为 。
(3)甲同学在进行实验时,为减小误差,应注意的事项有(填选项字母) 。
A.读数前应使整套装置冷却至室温
B.调整Z的高度使量气装置左右液面相平
C.读数时视线与Z内凹液面最低点相切
D.读数前应通入一定量的N2使生成的CO2全部进入量气装置
(4)按乙同学的实验方案进行实验,使测得的Na2CO3的质量分数偏高的因素有(写一种) 。
(5)为完成相同的测定任务,下列实验方案不能达到实验目的的是 (填选项字母)。
A.取mg混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干得ng固体
B.取mg混合物与足量盐酸充分反应,将溶液加热、蒸干、灼烧得ng固体
C.取mg混合物充分加热,固体质量减少ng
D.将图II装置中的稀硫酸改为稀盐酸进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,将22.4 L HCl完全溶于1 L水中(水的密度近似为1 g/mL),溶液的密度为ρ g/cm3,溶液的体积为V mL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w=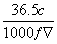 ×100% ②c=1 mol·L-1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w ④所得溶液中含有NA个HCl分子
×100% ②c=1 mol·L-1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w ④所得溶液中含有NA个HCl分子
A.全部 B.①③④ C.①③ D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中物质的量浓度为1 mol·L-1的是( )
A.将40 g NaOH溶解在1 L水中
B. 将22.4 L HCl气体溶于水配成1 L溶液
将22.4 L HCl气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1的浓盐酸加入9 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO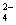 完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol·L-1)为( )
完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol·L-1)为( )
A.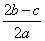 B.
B.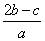 C.
C.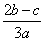 D.
D.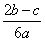
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,某硫酸铜溶液的质量分数为w,物质的量浓度为c mol/L,密度为ρ g/mL,将此溶液蒸去a g水或再向原溶液中加入b g无水硫酸铜粉末,充分静置并恢复至25 ℃时,均恰好全部转化为CuSO4·5H2O晶体。则下列关系式正确的是
A.c=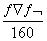 B.w=
B.w=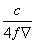
C.16a=9b  D.9a=16b
D.9a=16b
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列叙述正确的是 ( )
A.标准状况下,4.0 g CH4中含有共价键的数目为NA
B.常温常压下,6.4 g氧气和臭氧中含有的分子总数为0.2NA
C. 0.3 mol·L-1的NH4NO3溶液中含有的NO3-数目为0.3NA
D.一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切.
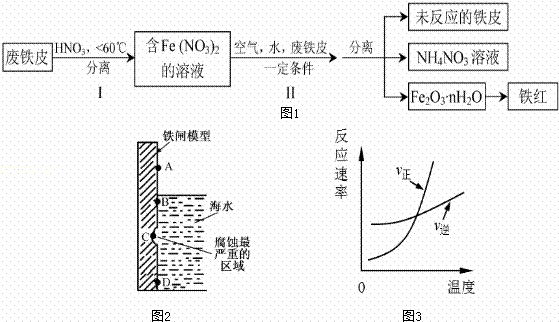
(1)如图2是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图这一腐蚀过程中发生还原反应的物质是 (填化学式).图2中A、B、C、D四个区域,生成铁锈最多的是 (填字母).
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:(图1)
步骤 I若温度过高,将不利于反应的进行,用适当的文字和化学方程式进行解释: .
步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O→2Fe2O3?nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 上述生产流程中,能体现“绿色化学”思想的是 (任写一项).
(3)已知t℃时,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数为K1.写出K1的表达式 .若该反应在恒容容器中反应时满足图3所示变化,则该反应的正反应为 反应(选填“吸热”或“放热”).若在t℃的2L恒温密闭容器中加入0.02mol FeO(s),并通入一定量CO.若5min后FeO(s)转化率为50%,则CO2的平均反应速率为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com