
| A�� | ��Ӧ2Mg��s��+CO2��g��=C��s��+2MgO��s�����Է����У���÷�Ӧ�ġ�H��0 | |
| B�� | Ϊ������������ĺڰߣ�Ag2S�������������������������ʳ��ˮ�в������Ӵ� | |
| C�� | �����£���ϡCH3COONa��Һ��ˮϡ�ͺ���Һ��n��H+��•n��OH-������ | |
| D�� | ��ʢ��Ca��OH��2����Һ�ľ����ܱ������У�����������CaO��ĩ����Һ��Ca2+��Ŀ���䣬pH���� |
���� A�������G=��H-T��S��0����÷�Ӧ���Է����У�
B��Ag��Al��ʳ��ˮ����ԭ��أ������������õ��ӷ�����ԭ��Ӧ��
C�������£���������ϡ�ͺ�Ũ�Ƚ��ͣ����������ˮ��̶���������Һ��c��OH-����С���¶Ȳ��䣬���ӻ��������䣻
D��CaO��ˮ��Ӧ�������������ҷų��������ų�������������Һ�¶����ߣ��������������ܽ�ȣ�
��� �⣺A�������G=��H-T��S��0����÷�Ӧ���Է����У���Ӧ2Mg��s��+CO2��g��=C��s��+2MgO��s�����Է����У����ر�С��0�����H��0����A��ȷ��
B��Ag��Al��ʳ��ˮ����ԭ��أ������������õ��ӷ�����ԭ��Ӧ���������Ag���Ӷ���ȥ��������B��ȷ��
C�������£���������ϡ�ͺ�Ũ�Ƚ��ͣ����������ˮ��̶���������Һ��c��OH-����С���¶Ȳ��䣬���ӻ��������䣬n��H+��•n��OH-��=c��H+��V��c��OH-��V=Kw��V2����Һ�����������n��H+��•n��OH-������C����
D��CaO��ˮ��Ӧ�������������ҷų��������ų�������������Һ�¶����ߣ��������������ܽ�ȣ���Ca2+��Ŀ��С��pH���ͣ���D����
��ѡCD��
���� ���⿼����ۺϣ��漰�������ܽ�ƽ�⡢����ˮ�⡢ԭ���ԭ����֪ʶ�㣬���ؿ���ѧ�������ж���������ȷ�������ܽ��ص㡢����ˮ���ص��ǽⱾ��ؼ����״�ѡ����CD��ע��DΪ�����ȡ������ᵼ����Һ�¶����ߣ����������ܽ�������¶����߶����ͣ�Ϊ�״��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Mg | B�� | Mg | C�� | $\frac{M}{6.02��1{0}^{23}}$g | D�� | Mg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �����£�����AgCl����ı�����Һ��������ˮϡ�ͣ�c��Ag+����Ksp��AgCl�������ֲ��� | |
| B�� | pH=5��CH3COOH��CH3COONa�Ļ����Һ�У�c��Na+����c��CH3COO-�� | |
| C�� | ��0.2mol/LCH3COOH��Һ��0.1mol/LNaOH��Һ�������ϣ���Ӧ��Ļ����Һ�У�2c��OH-��+c��CH3COO-��=2c��H+��+c��CH3COOH�� | |
| D�� | ��ˮ������У��ܴٽ�ˮ�ĵ��룬Kw����pH������Һ�ʼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
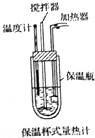 ��ѧ��Ӧ���������ǰ����������ı仯������������ת����
��ѧ��Ӧ���������ǰ����������ı仯������������ת�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
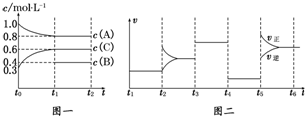
| t1��t2 | t2��t3 | t3��t4 | t4��t5 | t5��t6 |
| K1 | K2 | K3 | K4 | K5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ag C2H4��C3H6�Ļ��������ԭ������Ϊ$\frac{a{N}_{A}}{14}$ | |
| B�� | 0.5mol/L MgCl2��Һ������Cl-������ΪNA | |
| C�� | 10 mL��������Ϊ98%��H2SO4����ˮϡ����100 mL��H2SO4����������Ϊ9.8% | |
| D�� | 300 mL 2 mol/L������Һ����������������0.6NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ����Aһ��ΪHCl | B�� | ��Һ�������ʿ��ܺ�NaAlO2 | ||
| C�� | ��������Ҫ�ɷֲ��ǹ���� | D�� | ��Ӧ1����Ӧ2����������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �������Լ������ʵ���Ũ��Ϊ18.4 | |
| B�� | ��������������ˮ���������Һ����������С��49% | |
| C�� | ����50.0mL4.6mol•L-1��ϡ������ȡ������12.5mL | |
| D�� | 2.4gMg�������ĸ����ᷴӦ�õ�H2 �����Ϊ2.24L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com