分析:(1)①根据化学方程式,依据化学平衡三段式列式进行计算,根据转化率=
×100%,依据平衡常数概念计算得到;
②根据化学平衡移动原理的有关知识来回答;
(2)①由图象数据可知,由方程式2NO(g)+O
2(g)?2NO
2(g)可知,平衡时△c(NO):△c(O
2):△c(NO
2)=2:1:2,为据此判断表示,浓度变化的曲线,分别为b为NO,c为O
2,aNO
2,由图中数据可知2s内,O
2的浓度变化量为0.005mol/L-0.002mol/L=0.003mol/L,根据v=
计算v(O
2);
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
③根据外界条件对反应速率与平衡的移动分析解答;
(3)根据影响化学平衡移动的因素以及化学平衡移动的方向来判断即可,根据影响化学反应速率的因素:温度、浓度、压强、催化剂来确定化学反应达平衡用到的时间,根据影响化学平衡移动的因素:温度、浓度、压强来确定化学平衡中各个量的变化情况.
解答:
解:(1)根据化学方程式和三段式列式计算:
N
2(g)+3H
2(g)?2NH
3(g)
初始浓度; 0.6 0.45 0
变化浓度:0.5 0.15 0.1
平衡浓度:0.1 0.3 0.1
该条件下H
2的转化率=
×100%≈33.3%,
平衡常数K=
=
=3.7(L/mol)
2故答案为:33.3%;3.7(L/mol)
2;
③根据化学平衡:N
2(g)+3H
2(g)?2NH
3(g),反应是气体体积减小的放热反应,欲提高 H
2的转化率,平衡正向进行;
a.向容器中按原比例再充入原料气,则压强增大,平衡向右移动,氢气的转化率增大,故a正确;
b.向容器中再充入惰性气体,则各组分浓度不变,平衡不移动,氢气的转化率不变,故b错误;
c.改变反应的催化剂,不影响平衡的移动,氢气的转化率不变,故c错误;
d.液化生成物分离出氨,平衡向右移动,氢气的转化率增大,故d正确;
故选ad.
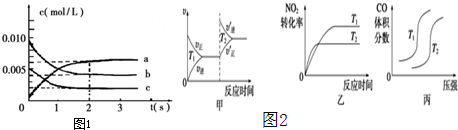
(2)①由图象数据可知,由方程式2NO(g)+O
2(g)?2NO
2(g)可知,平衡时△c(NO):△c(O
2):△c(NO
2)=2:1:2,为据此判断表示,浓度变化的曲线,分别为b为NO,c为O
2,aNO
2,由图中数据可知2s内,O
2的浓度变化量为0.005mol/L-0.002mol/L=0.003mol/L,根据v=
计算v(O
2)=
=0.0015mol/L?min;
故答案为:0.0015mol/L?min;
②能说明该反应已经达到平衡状态的是当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变;
a.未指明正逆速率,若都为同一方向速率,始终都存在v(NO
2)=2v(O
2)关系,故不能说明到达平衡,若为不同方向的速率,速率之比等于化学计量数之比,说明到达平衡,故a错误;
b.随反应进行气体的物质的量减小,压强增减小,容器内压强保持不变,说明到达平衡,故b正确;
c.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v
逆(NO)=2v
正(O
2),说明到达平衡,故c正确;
d.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,故d错误;
故选bc;
③为使该反应的反应速率增大,且平衡向正反应方向移动依据平衡移动原理分析判断;
a.及时分离出NO
2气体,平衡向正反应移动,但反应速率降低,故a错误;
b.适当升高温度,反应速率增大,平衡向逆反应移动,故b错误;
c.增大O
2的浓度,反应速率增大,平衡向正反应移动,故c正确;
d.选择高效的催化剂,增大反应速率,不影响平衡移动,故d错误;
故选C;
(3)甲:升高温度,化学平衡逆向移动,化学反应速率会迅速增大,会离开原来的速率点,故甲错误;
乙:升高温度,化学反应速率会迅速增大,所以T
2时先达到化学平衡状态,并且化学平衡逆向移动,二氧化氮的转化率减小,故乙正确;
丙:对于反应:4CO(g)+2NO
2(g)?4CO
2(g)+N
2(g),T不变,增大压强,平衡正向移动,一氧化碳的体积分数会减小,故丙错误.
故答案为:乙.

 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.

 如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
 A、B、D、X、Y是由短周期元素组成的化合物,其中X是常见的强酸(如盐酸)、Y是常见的强碱(如氢氧化钠),它们的相互转化关系如右图(部分生成物和水略去).
A、B、D、X、Y是由短周期元素组成的化合物,其中X是常见的强酸(如盐酸)、Y是常见的强碱(如氢氧化钠),它们的相互转化关系如右图(部分生成物和水略去).