
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2?H2的转化率 |
| B、工业上利用电解熔融的氧化铝制取铝,电解熔融的氧化镁制取镁 |
| C、电解精炼铜时,同一时间内阴极溶解铜的质量比阳极析出铜的质量小 |
| D、从海带中提取碘单质的实验中,要经过煅烧、溶解、过滤和萃取等操作 |


科目:高中化学 来源: 题型:
| A、向稀硫酸中加入氢氧化钡溶液 H++SO42-+Ba2++HO-=H2O+BaSO4↓ |
| B、向石灰水中加入硝酸溶液 H++OH-=H2O |
| C、向氧化镁中加入硫酸溶液 Mg2++SO42-=MgSO4 |
| D、向硝酸银溶液中加入锌粉 Zn+Ag+=Zn2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 阳离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全时的pH | 3.2 | 5.2 | 11.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:
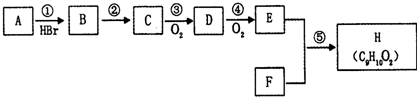
查看答案和解析>>
科目:高中化学 来源: 题型:
 固体A的试剂瓶签已部分被腐蚀(如图所示).已知固体A只可能是Na2CO3、Na2SO3和Na2SO4中的一种.若取少量固体A配成稀溶液进行实验鉴定,下列说法错误的是( )
固体A的试剂瓶签已部分被腐蚀(如图所示).已知固体A只可能是Na2CO3、Na2SO3和Na2SO4中的一种.若取少量固体A配成稀溶液进行实验鉴定,下列说法错误的是( )| A、只用盐酸一种试剂就可以确定该固体A的成分 |
| B、依次加入Ba(NO3)2溶液、盐酸,若有白色沉淀,则固体A为Na2SO4 |
| C、滴入酸性KMnO4溶液,若KMnO4溶液褪色,则固体A为Na2SO3 |
| D、用pH试纸检验(常温),若pH>7,则固体A可能是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
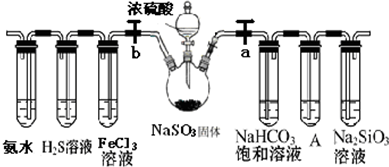
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
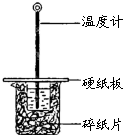 某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )| A、该实验也可在保温杯中进行 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是保温、隔热,减少热量损失 |
| D、若将盐酸体积改为60 mL,两次实验所求得中和热不相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com