
| A. | 碱性:KOH>NaOH | B. | 氧化性:Cl2>S | C. | 稳定性:HBr>HI | D. | 酸性:H3PO4>HNO3 |
科目:高中化学 来源: 题型:解答题
 (2)乙炔的结构式H-C≡C-H
(2)乙炔的结构式H-C≡C-H查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量和电子数 | B. | 电子层数和最外层电子数 | ||
| C. | 电子层数和次外层电子数 | D. | 相对原子质量和最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验氯乙烷中的氯元素,水解后再用硫酸酸化 | |
| B. | 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化 | |
| C. | 为了抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 检验溶液中是否含有SO42-时,先用盐酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
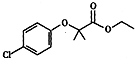
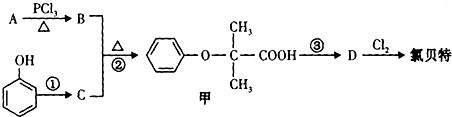
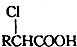

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
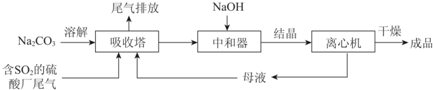
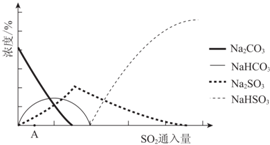
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3•7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3•7H2O在空气中易被氧化. |
 2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42-+2CH3COOH2+ | |
| B. | H2SO4的冰醋酸溶液中:c(CH3COOH2+)=c(HSO4-)+2c(SO42-)+c(CH3COO-) | |
| C. | 浓度均为0.1mol•L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3) | |
| D. | 向HNO3的冰醋酸溶液中加入冰醋酸,$\frac{c(C{H}_{3}COO{{H}_{2}}^{+})}{c(HN{O}_{3})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化镁与稀盐酸反应:H++OH-═H2O | |
| B. | 氯化钡溶液与硫酸钠溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | FeCl3溶液中加入Fe粉:Fe3++Fe═2Fe2+ | |
| D. | 碳酸钠溶液与足量醋酸反应:Na2CO3+2H+═2Na++CO2↑+H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
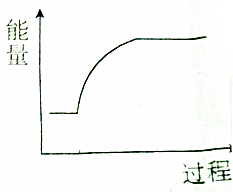
| A. | 钠与水反应 | B. | 钠的熔化过程 | ||
| C. | 氢氧化钠溶液与稀盐酸反应 | D. | Na2O2+H2O→NaOH+O2(未配平) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com