
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 放热反应不需要加热就能发生 | |
| C. | 吸热反应在一定条件(如常温、加热等)也能发生 | |
| D. | 化学反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对高低 |
分析 A.化学反应在发生物质变化的同时还伴随着能量的变化;
B.有的放热反应也需要加热反应条件;
C.有的吸热反应在一定条件下(如常温、加热等)能发生;
D.反应的能量变化取决于反应物和生成物能量高低.
解答 解:A.化学反应中除了遵循质量守恒定律,还遵循能量守恒定律,化学反应中的能量变化通常表现为热量的变化.所以化学反应除了生成新的物质外,还伴随着能量的变化,能量变化通常表现为热量的变化,即放热和吸热,故A正确;
B.有的放热反应需要在加热的条件下才能发生,如铝热反应是放热反应,需要在加热的条件下进行,故B错误;
C.吸热反应在一定条件下(如常温、加热等)也能发生,如Ba(OH)2•8H2O晶体与NH4Cl晶体的反应属于吸热反应,在常温下就能进行,碳能与二氧化碳属于吸热反应,在加热条件下反应,故C正确;
D.化学反应放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量,依据能量守恒分析判断反应能量变化,故D正确;
故选B.
点评 本题考查化学反应中的能量变化、放热反应和吸热反应的判断等,难度不大.正确理解放热、吸热的本质是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
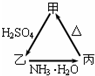 甲、乙、丙三种物质之间有如右图所示的转化关系:
甲、乙、丙三种物质之间有如右图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、CO32- | B. | NH4+、Na+、Cl-、SO42- | ||
| C. | Na+、HCO3-、NO3-、SO42- | D. | K+、MnO4-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
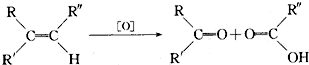 ,现有二烯烃C10H18与KMnO4溶液作用后可得到三种有机物:( CH3)2CO、CH3COOH、CH3CO(CH2)2COOH,由此推断二烯烃可能的结构简式为(CH3)2C═CHCH2CH2C(CH3)═CHCH3.
,现有二烯烃C10H18与KMnO4溶液作用后可得到三种有机物:( CH3)2CO、CH3COOH、CH3CO(CH2)2COOH,由此推断二烯烃可能的结构简式为(CH3)2C═CHCH2CH2C(CH3)═CHCH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 附着在试管内壁上的AgCl固体可用氨水溶解而洗去 | |
| B. | 可用氨水鉴别AlCl3、AgNO3和CuSO4三种溶液 | |
| C. | 向氨水中滴加CuSO4溶液至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液 | |
| D. | 加热碘单质,产生紫色蒸气,这个过程克服了范德华力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| B. | 在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化 | |
| C. | 食盐是咸味剂,工业上常用电解饱和食盐水制备氯气和钠 | |
| D. | 太阳能电池板中的硅是二氧化硅,光导纤维的主要成分是硅单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com