
下列事实,不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+H2O HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
B.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
C.高压比常压有利于合成SO3的反应
D.对CO(g) + NO2 (g)  CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深
CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深
科目:高中化学 来源:2014-2015学年湖北武汉市高三毕业生四月调研测试理综化学试卷(解析版) 题型:选择题
25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3) 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:实验题
B.【实验化学】
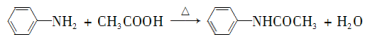
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:
已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3 ℃ | 305 ℃ | 0.46 |
苯胺 | -6 ℃ | 184.4 | 3.4 |
醋酸 | 16.6 ℃ | 118 ℃ | 易溶 |
实验步骤如下:
步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照下图装置组装仪器。

步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
请回答下列问题:
(1)步骤1中加入锌粉的作用是____。
(2)步骤2中控制温度计示数约105 ℃的原因是____。
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是____。抽滤装置所包含的仪器除减压系统外还有________、________(填仪器名称)。
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是____。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列实验操作或装置正确的是

A.利用图1所示操作制备氢氧化铁胶体
B.利用图2所示装置制取NH3
C.利用图3所示装置证明H2CO3酸性强于苯酚
D.利用图4所示装置制备乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河北区高三总复习质量检测一化学试卷(解析版) 题型:填空题
(18分)Ⅰ.有机物A的结构简式为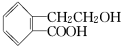 ,它可通过不同化学反应分别制得B、C和D三种物质。
,它可通过不同化学反应分别制得B、C和D三种物质。

(1)B中含氧官能团的名称是________。
(2)A →C的反应类型是________;A~D中互为同分异构体的是________。
(3)由A生成B的化学方程式是______________________________________。
Ⅱ.某芳香族化合物H常用作防腐剂,H可利用下列路线合成:
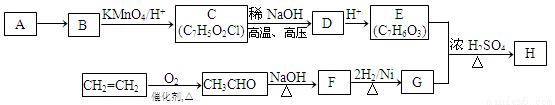
已知:①A是相对分子质量为92的烃;
②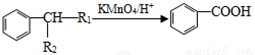
③ (-R1、-R2表示氢原子或烃基);
(-R1、-R2表示氢原子或烃基);
④D的核磁共振氢谱表明其有两种不同化学环境的氢(两种不同位置的氢原子),且峰面积之比为1:1。
回答下列问题:
(1)A的分子式为___________。
(2)同时符合下列条件的E的同分异构体共有____________种。
①分子中含有苯环
②能发生银镜反应
③能与FeCl3溶液发生显色反应
(3)检验F中含氧官能团的试剂为____________(填试剂名称),由F→G的反应类型为______。
(4)H的结构简式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市高三3月月考化学试卷(解析版) 题型:实验题
(本题12分)滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中。某研究性学习小组的同学利用滴定分析法进行下面两项定量分析。
(1)测定NaOH和Na2CO3的混合液中NaOH的含量。实验操作为:先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为 ,为何此种情况能测出NaOH的含量? 。
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI 3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后用5.0×10-4mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2 +2S2O32-
3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后用5.0×10-4mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2 +2S2O32- 2I-+S4O62-)。取用Na2S2O3标准溶液应该用 式滴定管。有关实验数值如下表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
2I-+S4O62-)。取用Na2S2O3标准溶液应该用 式滴定管。有关实验数值如下表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
第一次 | 25.00 | 0.00 | V= |
第二次 | 25.00 | 0.00 | 14.99 |
第三次 | 25.00 | 0.00 | 15.01 |

该碘盐中碘元素的百分含量为 ,下列操作中,会导致所测得的碘元素的百分含量偏大的是 。
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市高三3月月考化学试卷(解析版) 题型:选择题
如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是
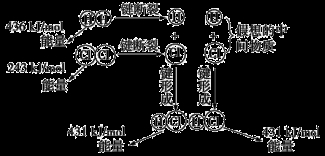
A.1 mol H2中的化学键断裂时需要吸收436 kJ能量
B.2 mol HCl分子中的化学键形成时要释放862 kJ能量
C.此反应的热化学方程式为H2(g)+Cl2(g)  2HCl(g) ΔH=+183 kJ·mol-1
2HCl(g) ΔH=+183 kJ·mol-1
D.此反应的热化学方程式为1/2H2(g)+1/2Cl2(g)  HCl(g) ΔH=-91.5 kJ·mol-1
HCl(g) ΔH=-91.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古鄂尔多斯市高三模拟化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质](15分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;B的最外层电子数为其内层电子数的3倍;A与C可形成离子化合物C3A2;D是地壳中含量最多的金属元素;E原子核外的M层中有两对成对电子;F原子核外最外层只有1个电子,其余各层电子均充满。根据以上信息,回答下列问题:(A、B、C、D、E、F用所对应的元素符号表示)。
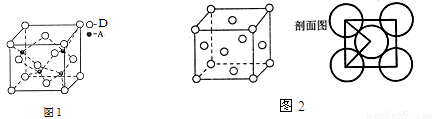
(1)F原子的核外电子排布式为 ,A、B、C、D、E的第一电离能最小的是 。
(2)C的氧化物的熔点远高于E的氧化物的熔点,原因是 。
(3)比较B、E的氢化物的沸点_________。
(4)A的最高价含氧酸根离子中,其中心原子是 杂化,E的低价氧化物的空间构型为 。
(5)A、D形成某种化合物的晶胞结构如图1,则其化学式为 。
(6)F单质的晶体的晶胞结构如图2。若F原子的半径是r cm,则F单质的密度的计算公式是 。(用NA表示阿伏伽德罗常数)
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省达州市高二3月月考化学试卷(解析版) 题型:选择题
将浓度为0.2mol/LNH4Cl溶液加水不断稀释,下列各量增大的是
A.c(H+) B.Kh(NH4Cl)(水解常数)
C.c(OH— D.c(NH4+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com