
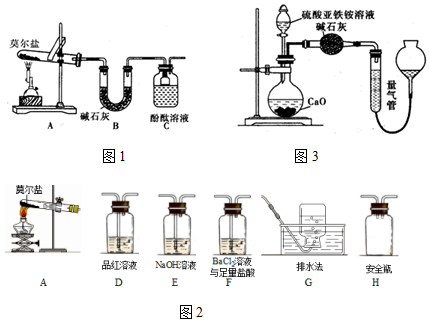
分析 Ⅰ.(1)莫尔盐[(NH4)2Fe(SO4)2•6H2O]受热分解,分解时会产生氨气和二氧化硫、三氧化硫等酸性气体,根据装置图可知,碱石灰可以吸收酸性气体,氨气遇到酚酞溶液会变红色;
(2)①要检验生成SO3(g)、SO2(g)及N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,再通过品红溶液检验SO2,用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,据此答题;
②SO3通入氯化钡溶液中可以产生硫酸钡沉淀,H装置导气管都是略露出胶塞,起到安全瓶作用;
Ⅱ.(1)甲方案中的反应,酸性K2Cr2O7溶液氧化硫酸亚铁生成硫酸铁,亚铁离子具有还原性,易被氧化;
(2)根据氨气的溶解性和装置特点分析,氨气极易溶于水,气体通过不能是水溶液;
(3)读数时,应使左右压强相等;
(4)根据氨气的体积计算氨气的物质的量,根据N守恒计算出硫酸亚铁铵的质量,进而计算质量分数.
解答 解:Ⅰ.(1)莫尔盐[(NH4)2Fe(SO4)2•6H2O]受热分解,分解时会产生氨气和二氧化硫、三氧化硫等酸性气体,根据装置图可知,碱石灰可以吸收酸性气体,氨气遇到酚酞溶液会变红色,所以装置C 中可观察到的现象是溶液变红,由此可知莫尔盐晶体分解的产物中有 NH3.装置B的主要作用是 吸收分解产生的酸性气体,
故答案为:溶液变红;NH3;
(2)①要检验生成SO3(g)、SO2(g)及N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,再通过品红溶液检验SO2,用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,所以装置依次连接的合理顺序为A、H、F、D、E、G,
故答案为:FDE;
②SO3通入氯化钡溶液中可以产生硫酸钡沉淀,证明含有SO3的实验现象是 F中有白色沉淀,H装置导气管都是略露出胶塞,起到安全瓶作用,防止液体倒吸,
故答案为:F中有白色沉淀;防倒吸;
II.(1)重铬酸钾溶液具有氧化性,能氧化亚铁离子为铁离子,反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)乙方案中,装置中的导管在液面以上,符合排液体收集气体要求,量气管中液体应不能溶解氨气,氨气易溶于水和饱和碳酸钠溶液,难溶于四氯化碳,故用排四氯化碳法收集,故答案为:c;
(3)读数时,应使左右压强相等保证读数准确,可上下移动滴定管,使左右两边液面相平,
故答案为:上下移动量气管(滴定管),使左右两边液面相平;
(4)VL氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
m g硫酸亚铁铵样品中含N的物质的量为$\frac{500}{25}$×$\frac{V}{22.4}$mol=$\frac{20V}{22.4}$mol,
硫酸亚铁铵的纯度为:$\frac{\frac{20V}{22..4}×\frac{1}{2}mol×392g/mol}{mg}$×100%=$\frac{392V×20}{44.8m}$×100%,
故答案为:$\frac{392V×20}{44.8m}$×100%.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,难点是排列实验先后顺序,根据实验目的及物质的性质进行排列顺序,注意要排除其它因素干扰,题目难度中等.


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 操作 | 现象 |
| A | 验证BaSO3难溶于水 | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 |
| B | 验证非金属性:Br>I | 将溴水滴加到淀粉KI溶液中 | 溶液变蓝 |
| C | 验证SO2的漂白性 | 将SO2通入氯水中 | 氯水褪色 |
| D | 验证某化合物是钠盐 | 将该化合物在酒精灯上灼烧 | 焰色为黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化铁与稀硫酸反应:Fe2O3+6H+═Fe2++3H2O | |
| B. | 石灰石溶于盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:Cu2++2OH-═Cu(OH)2↓ | |
| D. | 碳酸氢钙溶液与盐酸反应:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水,
现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
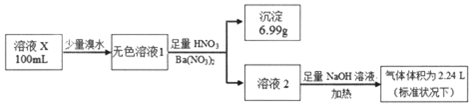
| A. | 溶液X肯定只存在NH4+、SO42- | |
| B. | 溶液X一定不含有Ba2+、Fe3+,可能含有I- | |
| C. | 为确定可能存在的阴离子,可另取试液滴加足量盐酸、BaCl2溶液 | |
| D. | 为确定可能存在的阳离子,可用经过稀硫酸洗过的铂丝蘸取溶液X在酒精灯火焰上灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- | |
| B. | 在含等物质的量的FeBr2、FeI2溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含等物质的量的KOH、Ba(OH)2溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 | |
| D. | 在含等物质的量的Fe3+、Cu2+、H+溶液中加入锌粉:Fe3+、Cu2+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
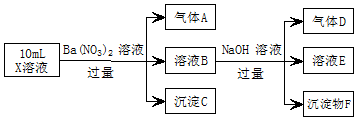 某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO42-、C1-中的若干种,现取X溶液进行实验,实验过程及产物如图:下列说法正确的是( )
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO42-、C1-中的若干种,现取X溶液进行实验,实验过程及产物如图:下列说法正确的是( )| A. | A是一种无色、无毒的气体 | |
| B. | 沉淀F为Fe(OH)2 | |
| C. | 实验室可用排水法收集气体D | |
| D. | 往溶液E中通入少量CO2,有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | NH${\;}_{4}^{+}$ | C. | HCO${\;}_{3}^{-}$ | D. | OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com