
| A. | ①②③⑥ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ②③④ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 ,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O .
,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O .查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3 是还原剂 | B. | CO是氧化剂 | ||
| C. | 氧化剂得到6mol电子 | D. | 还原剂失去8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.5mol•L-1•S-1 | B. | υ(B)=0.3 mol•L-1•S-1 | ||
| C. | υ(C)=0.8mol•L-1•S-1 | D. | υ(D)=1 mol•L-1•S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑧⑨⑩ | B. | ⑦⑧⑨ | C. | ③⑦⑩ | D. | ⑦⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
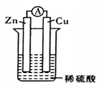
| A. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| B. | 经过一段时问工作后'电解液的pH值减小 | |
| C. | 锌片是正极,铜片上有气泡产生 | |
| D. | 电流方向是从锌片流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质能透过滤纸 | B. | 胶体粒子直径在1nm~100nm之间 | ||
| C. | 胶体具有丁达尔现象 | D. | 胶体和其它分散系都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能/kJ.mol-1 | a | b | x | c | d |
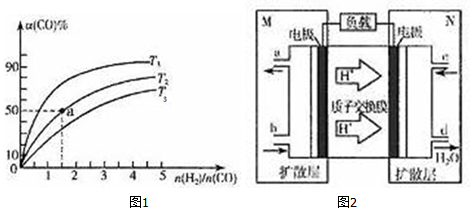
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com