
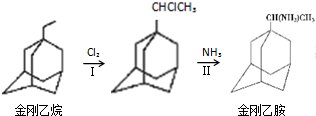
 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
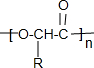 .
. .
.分析 (1)①金刚乙烷中有12个C原子,20个H原子;
②金刚乙烷与氯气发生取代反应,反应Ⅱ也是取代反应,同时生成HCl;
(2)已知:E分子中有两个C=O双键,但不能发生银镜反应;标准状况下,1molF与足量的钠完全反应会生成22.4L气体,若与足量NaHCO3溶液完全反应也会生成22.4L气体,可知:
①A→B是卤代烃的消去反应,B为R-CH=CH2;
②B→C发生加成反应,C为R-CHBrCH2Br,C→D为卤代烃的水解反应,D为R-CHOHCH2OH;
③D→E为时多步氧化,生成的E分子中有两个C=O双键,但不能发生银镜反应,所以E为 ,标准状况下,1molF与足量的钠完全反应会生成22.4L气体,若与足量NaHCO3溶液完全反应也会生成22.4L气体,说明F中有羟基和羧基,F为R-CHOHCOOH,其通过缩合反应生成G,G为
,标准状况下,1molF与足量的钠完全反应会生成22.4L气体,若与足量NaHCO3溶液完全反应也会生成22.4L气体,说明F中有羟基和羧基,F为R-CHOHCOOH,其通过缩合反应生成G,G为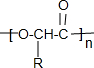 ;
;
④F为R-CHOHCOOH,分子式为C12H18O3,其分子组成中含有4个不饱和度,苯环中有4个不饱和度,据所给条件判断其同分异构体.
解答 解:(1)金刚乙烷中有12个C原子,20个H原子,分子式为C12H20,故答案为:C12H20;
②金刚乙烷与氯气发生取代反应,反应Ⅱ也是取代反应,同时生成HCl,故答案为:取代反应;HCl;
(2)①A→B是卤代烃的消去反应,B为R-CH=CH2,反应条件为NaOH的乙醇溶液加热,故答案为:NaOH的乙醇溶液加热;
②B→C发生加成反应,C为R-CHBrCH2Br,C→D为卤代烃的水解反应,D为R-CHOHCH2OH,反应方程式为:R-CHBrCH2Br+2NaOH$\stackrel{△}{→}$R-CHOHCH2OH+2NaBr,
故答案为:NaOH的水溶液加热;R-CHBrCH2Br+2NaOH$\stackrel{△}{→}$R-CHOHCH2OH+2NaBr;
③E为 ,含有羰基和羧基两种官能团,F为R-CHOHCOOH,其通过缩合反应生成G,G为
,含有羰基和羧基两种官能团,F为R-CHOHCOOH,其通过缩合反应生成G,G为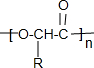 ,
,
故答案为:羰基和羧基;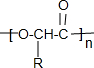 ;
;
④F为R-CHOHCOOH,分子式为C12H18O3,属于芳香族化合物且分子中含有6个甲基,则苯环的每个C原子上连有一个甲基,且分子中只有两种不同化学环境的氢原子,只能是3个O原子在甲基和苯环之间,且与其他3个甲基处于间位,其结构简式只能是: ,
,
故答案为: .
.
点评 本题考查了有机物的推断,难度中等,注意以反应条件为突破口进行推断,再G进行推断,需要学生熟练掌握官能团的性质与转化.


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. |  如图所示装置完成实验室制氨气 | |
| B. |  如图所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. |  如图所示装置除去HCl中含有的少量Cl2 | |
| D. |  如图所示装置可用于分离二氧化锰和二氯化锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z、W、M的原子半径由大到小的顺序为Z>W>M | |
| B. | M分别与Z、W所形成的物质的晶体类型相同 | |
| C. | X2Y2易溶于X2Y中,是由于X2Y2与X2Y能形成分子间氢键 | |
| D. | 将Z2Y在空气中加热可得到Z2Y2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷自燃而氮气在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液 | a | b | c | d | e |
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
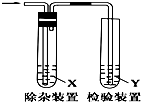 用图所示装置检验乙烯时不需要除杂的是( )
用图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 溴水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向FeCl3溶液中滴加NaOH溶液 | 制备Fe(OH)3胶体 |
| B | 将CO2通入水玻璃溶液中 | 证明C元素的非金属性大于Si |
| C | 向苯和苯酚的混合溶液中加入足量的浓溴水,充分反应后过滤 | 除去苯中混有的苯酚 |
| D | 淀粉与稀H2SO4共热,再加入银氨溶液水浴加热 | 验证淀粉水解产物有无还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①③④⑤ | C. | ①④⑤⑥ | D. | ②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com