
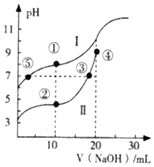
 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为 0.10mol•L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为 0.10mol•L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )| A. | 曲线I和曲线Ⅱ分别代表的是CH3COOH和HCN | |
| B. | 点③和点⑤所示溶液中:c(CN-)=c(CH3COO-) | |
| C. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) | |
| D. | 在点②和③之间(不包括端点)存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) (A-代表溶液中的酸根离子) |
分析 常温下用0.10mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/LCH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10),对于同浓度同体积的CH3COOH和HCN来说,根据电离平衡常数可判断酸性CH3COOH>HCN,则起始时HCN的起点高于CH3COOH的起点,当滴加NaOH溶液的体积为10mL时,此时两种溶液中起始时分别恰好生成c(HCN):c(NaCN)=1:1,c(CH3COOH):c(CH3COONa)=1:1,当滴加NaOH的体积是20mL时,此时为化学计量点,溶液中分别恰好生成CH3COONa和HCN,结合图象和溶液中的守恒思想,据此判断分析.
解答 解:常温下用0.10mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/LCH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10),对于同浓度同体积的CH3COOH和HCN来说,根据电离平衡常数可判断酸性CH3COOH>HCN,起始时HCN的起点高于CH3COOH的起点,当滴加NaOH溶液的体积为10mL时,此时两种溶液中起始时分别恰好生成c(HCN):c(NaCN)=1:1,c(CH3COOH):c(CH3COONa)=1:1,当滴加NaOH的体积是20mL时,此时为化学计量点,溶液中分别恰好生成CH3COONa和HCN,
A.酸性CH3COOH>HCN,HCN电离出的H+更少,pH值更大,则起始时,在pH图象上,起点更高的是HCN,因此曲线I是HCN,曲线II是CH3COOH,故A错误;
B.点③和点⑤表示的溶液中,溶液均为中性,则溶液中c(H+)=c(OH-),对于I,溶液中存在HCN和NaCN,对于II,溶液中存在CH3COONa和CH3COOH,分别根据电荷守恒,对于I:c(Na+)=c(CN-),对于II,c(Na+)=c(CH3COO-),根据图象,滴定CH3COOH时消耗NaOH溶液的量多,则c(CN-)<c(CH3COO-),故B错误;
C.点①和点②所示溶液中,所加NaOH溶液的体积均为10.00mL,I溶液的组分为NaCN和HCN的起始量为1:1,II溶液的组分为CH3COONa和CH3COOH的起始量为1:1,分别对于I溶液和II溶液,有物料守恒,I:2c(Na+)=c(CN-)+c(HCN)=$\frac{1}{15}$mol/L,II:2c(Na+)=c(CH3COOH)+c(CH3COO-)=$\frac{1}{15}$mol/L,则c(CN-)+c(HCN)=c(CH3COOH)+c(CH3COO-),因此c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),故C正确;
D.在点②和③之间(不包括端点),根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),根据图象,溶液一直是酸性,则c(H+)>c(OH-),因此溶液中c(Na+)<c(A-),故D错误.
故选C.
点评 本题考查酸碱滴定原理,弱电解质的电离平衡,盐类水解得知识,根据图象分析,牢牢把握溶液中的守恒思想是解题的关键,题目难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 完全沉淀 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.7 | 3.7 | - | - |
| Fe(OH)2 | 7.6 | 9.6 | ||
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | 为了达到目的,首先应在溶液中加入双氧水或氯水将Fe2+氧化为Fe3+ | |
| B. | 加入NaOH溶液,调节溶液的pH在9.6以上就能达到实验目的 | |
| C. | 本实验产生沉淀的顺序为Fe(OH)3→Al(OH)3→Fe(OH)2 | |
| D. | 实验中生成的Fe(OH)2迅速变为灰绿色,最终变为红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 判断苯分子中不存在碳碳单键与碳碳双键的交替结构的依据是:邻二甲苯只有一种结构 | |
| B. | 硝基苯分子中苯环上的一个H被-C4H9取代后形成的有机物共有12种 | |
| C. | 乙醇、乙酸、乙酸乙酯能发生取代反应 | |
| D. | 聚乙烯、苯乙烯都能使溴的四氯化碳溶液和酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )
常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )| A. | 常温下,PbI2的Ksp为2×10-6 | |
| B. | 温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变 | |
| C. | T时刻改变的条件是升高温度,因而PbI2的Ksp增大 | |
| D. | 常温下Ksp(PbS)=8×10 -28,向PbI2的悬浊液中加入Na2S溶液,PbI2 (s)+S2- (aq) PbS(s)+2I- (aq)反应的化学平衡常数为5×l018 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强一定能加快化学反应速率 | |
| B. | 使用催化剂,使反应的活化能降低,反应速率加快,但不改变反应的历程 | |
| C. | 反应物浓度是决定化学反应速率的主要因素 | |
| D. | 升高温度,一定能加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “84”消毒液消毒的原理和明矾净水的原理相同 | |
| B. | 利用生物质能就是间接利用太阳能 | |
| C. | 钾、镁、铁等金属有绚丽的颜色,可用于制造焰火 | |
| D. | 医疗上常用碳酸钡作X射线透视肠胃的内服药剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com