
【题目】下列物质的分类合理的是( )
A. 氧化物:NO、CO2、SO2、Na2O2
B. 碱:NaOH 、KOH 、Ca(OH)2、Na2CO3
C. 铵盐:NH4Cl 、NH4NO3、NH4HCO3、NH3·H2O
D. 碱性氧化物:Na2O、CaO、Al2O3、Fe2O3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有下列各种微粒或物质:
A.O2和O3 B. ![]() C和
C和![]() C C.CH3CH2CH2CH3和CH4
C C.CH3CH2CH2CH3和CH4
D.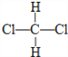 和
和 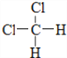 E.CH3CH2CH2CH3和
E.CH3CH2CH2CH3和
(1)________________组两种微粒互为同位素;(填字母,下同)
(2)________________组两种物质互为同素异形体;
(3)________________组两种物质属于同系物;
(4)________________组两物质互为同分异构体;
(5)_______________组两物质是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曾有制药厂违反规定,购入工业用“二甘醇”代替医用丙二醇(C2H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇而死亡。二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,用途十分广泛。二甘醇一般的合成路线为:

请回答下列问题:
(1)下列关于“丙二醇和“二甘醇”及“乙二醇”的有关说法正确的是____________
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程I是石油加工中常用步骤,其名称为_______。
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,写出实验室制备E的化学方程式___________,则为了能得到二甘醇D,物质B到物质C的反应条件是_________,该反应属于________(填反应类型)。写出B可能生成E的化学方程式______。
(4)反应Ⅲ的化学方程式为:____________。
(5)A的一种同系物结构简式为 请用系统命名法对其命名_______________。
请用系统命名法对其命名_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
①配位键在形成时,是由成键双方各提供一个电子形成共用电子对
②C60晶体的晶胞是面心立方结构
③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素
④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子
⑤冰中存在极性共价键和氢键两种化学键的作用
⑥Cu(OH)2是一种蓝色的沉淀,既溶于硝酸、浓硫酸,也能溶于氨水中
⑦熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、分子晶体
⑧氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式为![]()
A.②⑥ B.②③ C.⑤⑥ D.③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为( )
A. ![]() 、
、![]() B. AgCl、
B. AgCl、![]()
C. ![]() 、
、![]() D.
D. ![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(![]() )是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
I .【制备产品】
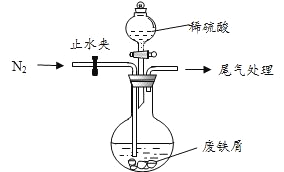
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用上图所示装置制备![]() 晶体,步骤如下:
晶体,步骤如下:
(1)预处理:先将废铁屑加入到饱和![]() 溶液中洗涤,目的是_____,然后将废铁屑用水洗涤2~3 遍。
溶液中洗涤,目的是_____,然后将废铁屑用水洗涤2~3 遍。
(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入![]() ,
,![]() 的作用是________。
的作用是________。
(3)再加入足量稀硫酸,控制温度 50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为_____________。
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤, ____________。
滤出晶体,用少量冰水洗涤 2~3 次,再用滤纸将晶体吸干,密闭保存。
II.【测定![]() 含量】
含量】
(1)称取上述样品 10.0g,溶于适量的稀硫酸中,配成 100mL 溶液,需要的仪器除天平、胶头滴管、 烧杯、量筒外,还需要的仪器有(填仪器名称)____________________、_______________________。
(2)准确量取 25mL 该液体于锥形瓶中,用 0.1000mol/L ![]() 标准溶液滴定,则滴定终点的判断方法是________________________。
标准溶液滴定,则滴定终点的判断方法是________________________。
(3)用同样的方法滴定 3 次,平均消耗 10.00mL 标准液,该样品中![]() 的质量分数为____________。(已知 Mr(
的质量分数为____________。(已知 Mr(![]() )=278)
)=278)
(4)若测量结果偏小,则可能是在定容时_________________(填“俯视”或“仰视”)读数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产、生活中的作用发生了巨大的变化。
(1)现代工业“接触法制硫酸”用黄铁矿(主要成分为FeS2)为原料。测得硫酸渣的化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):

请回答下列问题:
①在步骤i中产生的有毒气体可能有___________________。
②在步骤iii操作中,要除去的离子之一为Al3+,若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全,则溶液的pH为_________(注:c(Al3+)≤10-5mol·L-1视为沉淀完全)。
③步骤ⅳ中,洗涤沉淀的操作是___________________。
生成FeCO3的离子方程式是__________________。
(2)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_____________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:______________________。
(3)古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ⅱ的离子方程式是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com