

分析 Ⅰ.(1)沉淀是CuCO3说明,Na2CO3溶液与CuSO4溶液发生反应生成硫酸钠与碳酸铜,即碳酸根与铜离子反应生成碳酸铜沉淀;
Ⅱ.(3)利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验;
(4)碳酸铜可用澄清的石灰水检验产生的二氧化碳,澄清石灰水变浑浊说明含有CuCO3;
Ⅲ.(5)根据CuCO3和Cu(OH)2受热分解的产物和检验所产生的现象来连接装置;
(6)碱石灰可以吸收水和二氧化碳,空气中的水以及二氧化碳会干扰试验结果应该将其排除掉;
(7)装置B质量增加了n克,即生成水的质量是ng,根据原子守恒来回答.
解答 解:Ⅰ.(1)沉淀是CuCO3说明,Na2CO3溶液与CuSO4溶液发生反应生成硫酸钠与碳酸铜,即碳酸根与铜离子反应生成碳酸铜沉淀,反应离子方程式为CO32-+Cu2+=CuCO3↓,
故答案为:CO32-+Cu2+=CuCO3↓;
Ⅱ.(3)装置B检验是否有水生成,可用无水硫酸铜固体检验,若无水硫酸铜变蓝色说明有水生成,验证沉淀中有氢氧化铜生成,否则沉淀中无氢氧化铜,
故答案为:无水硫酸铜固体;
(4)用澄清的石灰水检验是否产生二氧化碳,装置C中澄清石灰水变浑浊,说明生成二氧化碳,即说明含有CuCO3,
故答案为:装置C中澄清石灰水变浑浊;
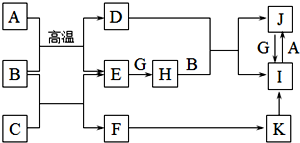
Ⅲ.(5)碱石灰可以吸收水和二氧化碳,空气中的水以及二氧化碳会干扰试验结果应该将其在实验之前排除掉,并在装置的最后放上碱石灰,防止空气中的水和二氧化碳来干扰试验结果,可以用浓硫酸来吸收水,用碱石灰来吸收二氧化碳,根据浓硫酸和碱石灰的增重量来确定生成水和二氧化碳的量,所以实验装置的连接顺序为e→f→a→b→d→c→g→h→j,
故答案为:a→b→d→c→g→h;
(6)装置C中碱石灰的作用是:吸收空气中的H2O 蒸汽和CO2,验开始时和实验结束时都要通入过量且处理过的空气其作用都是将装置中滞留的H2O 蒸汽和CO2排出,
故答案为:吸收空气中的H2O 蒸汽和CO2; 将装置中滞留的H2O 蒸汽和CO2排出;
(7)装置B质量增加了n克,即生成水的质量是ng,根据方程式则生成的氢氧化铜的物质的质量是:$\frac{98n}{18}$g=$\frac{49n}{9}$g,所以碳酸铜的质量是(m-$\frac{49n}{9}$g)g,质量分数为:$\frac{(1-\frac{49n}{9}\\;)g}{mg}$=1-$\frac{49n}{9m}$,
故答案为:1-$\frac{49n}{9m}$.
点评 本题考查实验方案设计与装置的理解评价、物质组成与含量的测定、实验基本操作,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ② | B. | ②④ | C. | ①③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液【FeCl3】:加足量铁粉 | B. | NaCl溶液【Na2SO4】:用Ba(OH)2溶液 | ||
| C. | Na2CO3固体【NaHCO3】:加热 | D. | 铁粉【铝粉】:用NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27克铝与足量的稀硫酸或氢氧化钠溶液充分反应,转移电子物质的量都为3 NA | |
| B. | 一瓶容积为22.4L 的NO2气体所含氮原子个数为NA | |
| C. | 浓度为0.2 mo1•L-1的CaC12溶液中,C1-离子的数目为0.4 NA | |
| D. | 标准状况下,22.4 L H2O含有的水分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时所得溶液中离子浓度间的关系有:5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3) | |
| B. | 常温下,pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能 | 组别 | c(HCl)(mol•L-1) | 温度(℃) | 状态 |
| A | 2.0 | 25 | 块状 |
| B | 2.5 | 30 | 块状 |
| C | 2.5 | 50 | 粉末状 |
| D | 2.5 | 50 | 块状 |
| A. | D-C-A-B | B. | C-D-B-A | C. | A-B-C-D | D. | A-B-D-C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com