
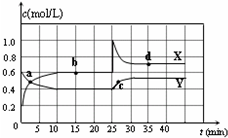
 ��֪NO2��N2O4�����ת����2NO2��g��?N2O4��g����H��0���ں��������½�һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ��Ũ����ʱ��仯��ϵ��ͼ������˵����ȷ���ǣ�������
��֪NO2��N2O4�����ת����2NO2��g��?N2O4��g����H��0���ں��������½�һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ��Ũ����ʱ��仯��ϵ��ͼ������˵����ȷ���ǣ�������| A�� | ͼ��Y�����DZ�ʾNO2Ũ����ʱ��ı仯���� | |
| B�� | ǰ10 min��v��N2O4��Ϊ0.1 mol/�� L•min�� | |
| C�� | 25 minʱ������ƽ���ƶ���ԭ���ǽ��ܱ������������СΪ1L | |
| D�� | 25 minʱ������ƽ���ƶ���ԭ����������ͨ������NO2 |
���� ��ͼ��֪0-10minƽ��״̬ʱ��X��ʾ���������Ũ�ȱ仯��Ϊ��0.6-0.2��mol/L=0.4mol/L��Y��ʾ�ķ�Ӧ���Ũ�ȱ仯��Ϊ��0.6-0.4��mol/L=0.2mol/L��X��ʾ���������Ũ�ȱ仯����Y��ʾ�ķ�Ӧ���Ũ�ȱ仯����2��������X��ʾNO2Ũ����ʱ��ı仯���ߣ�Y��ʾN2O4Ũ����ʱ��ı仯���ߣ�
A������X��Y��Ũ�ȱ仯��������Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ�ȷ����ʾNO2Ũ�ȱ仯���ߣ�
B����ͼ���֪��10 min����NO2��Ũ�ȱ仯��Ϊ��0.6-0.2��mol/L=0.4mol/L������v=$\frac{��c}{��t}$����v��NO2����
C��25minʱ��X��Ũ������Y��Ũ�Ȳ��䣬ֻ��������X��Ũ�ȣ�
D��25minʱ��X��Ũ������Y��Ũ�Ȳ��䣬ֻ��������X��Ũ�ȣ�
��� �⣺��ͼ��֪0-10minminƽ��״̬ʱ��X��ʾ���������Ũ�ȱ仯��Ϊ��0.6-0.2��mol/L=0.4mol/L��Y��ʾ�ķ�Ӧ���Ũ�ȱ仯��Ϊ��0.6-0.4��mol/L=0.2mol/L��X��ʾ���������Ũ�ȱ仯����Y��ʾ�ķ�Ӧ���Ũ�ȱ仯����2��������X��ʾNO2Ũ����ʱ��ı仯���ߣ�Y��ʾN2O4Ũ����ʱ��ı仯���ߣ�
A��������������֪��X��ʾNO2Ũ����ʱ��ı仯���ߣ�Y��ʾN2O4Ũ����ʱ��ı仯���ߣ���A����
B����ͼ���֪��10 min����NO2��Ũ�ȱ仯��Ϊ��0.6-0.2��mol/L=0.4mol/L����v��NO2��=$\frac{0.4mol/L}{10min}$=0.04mol/��L•min������B����
C��25minʱ��X��Ũ������Y��Ũ�Ȳ��䣬ֻ��������X��Ũ�ȣ��������߷����仯��ԭ��������NO2Ũ�ȣ����ǽ��ܱ������������СΪ1L����C����
D��25minʱ��X��Ũ������Y��Ũ�Ȳ��䣬ֻ��������X��Ũ�ȣ��������߷����仯��ԭ��������NO2Ũ�ȣ���D��ȷ��
��ѡD��
���� ���⿼�黯ѧ��Ӧ���ʼ���ѧƽ��ͼ��ע��������ߵı仯���ƣ���ȷ�ж����������ƽ���ƶ���Ӱ�죬��ȷͼ�����ݺ����꼰�㡢�ߡ�������壬�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ������ | ����� | ǿ����� | ������� | �ǵ���� |
| A | ʳ�� | �������� | ���� | С�մ� | HD |
| B | ��ͭ | ˮú�� | ���� | ���� | �Ҵ� |
| C | �ռ� | ˮ���� | ���ᱵ | һˮ�ϰ� | Һ�� |
| D | C12H22O11 | ���ȼ� | �������� | �������� | �������� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������CO2��SO2��SiO2 | B�� | ����Ư�ۡ���ˮ�����ȼ� | ||
| C�� | ����ʣ����������ᱵ���ƾ� | D�� | ͬ�������壺C60�����ʯ��ʯī |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����B��Ũ�ȣ�v��������v���棩 | |
| B�� | �����¶ȣ�ƽ�����淴Ӧ�����ƶ���v��������С | |
| C�� | ѹǿ����һ����ƽ�ⲻ�ƶ���v ��������v���棩���� | |
| D�� | ����A������ƽ��������Ӧ�����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Zn��s��+CuSO4��aq���TZnSO4��aq��+Cu��s����H=-216 kJ•mol-1����Ӧ���������������������� | |
| B�� | ��ͬ�����£�1mol��ԭ�������е�����ΪE1��1mol����ӵ�����ΪE2����2E1��E2 | |
| C�� | ��֪2H2��g��+O2��g���T2H2O��g����H=-483.6kJ•mol-1��H2��ȼ����Ϊ241.8kJ•mol-1 | |
| D�� | H+��aq��+OH-��aq���TH2O��l����H=-57.3kJ•mol-1����1molNaOH��NaOH��Һ�뺬0.5molH2SO4��Ũ�����Ϻ�ų�57.3kJ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com