
| A. | 瓦斯中甲烷和氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为1:2 | |
| B. | 欲配制1.00 L1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 22.4LN2和H2的混合气体中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,得到8NA个电子 |
分析 A.令甲烷与氧气的质量分别为1g、4g,根据n=$\frac{m}{M}$计算各自的物质的量,相同条件下,体积之比等于物质的量之比,据此计算;
B.物质的量浓度中体积为溶液的体积;
C.气体状况未知;
D.根据Fe3O4中铁为+$\frac{8}{3}$价来分析.
解答 解:A.令甲烷与氧气的质量分别为1g、4g,则:甲烷的物质的量为$\frac{1g}{16g/mol}$=$\frac{1}{16}$mol,氧气的物质的量为:$\frac{4g}{32g/mol}$=$\frac{1}{8}$mol,相同条件下,体积之比等于物质的量之比,故此时甲烷与氧气的体积比为$\frac{1}{16}$mol:$\frac{1}{8}$mol=1:2,故A正确;
B.可将58.5 g NaCl溶于1.00 L水中,溶液体积大于1.00L,则物质的量浓度小于1.00 mol•L-1,故B错误;
C.气体状况未知,Vm不确定,无法计算,故C错误;
D.Fe3O4中铁为+$\frac{8}{3}$价,故1mol铁反应失去$\frac{8}{3}$mol电子,3mol单质Fe完全转化为Fe3O4失去8mol电子,即8NA个,故D正确;
故选:AD.
点评 本题考查了阿伏伽德罗常数的综合应用,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间关系是解题关键,题目难度中等.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 熵变小于零而焓变大于零的反应肯定不能自发发生 | |
| B. | 热化学方程式中△H的值与反应物的用量有关 | |
| C. | 化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,但反应前后物质的总能量不变 | |
| D. | 其他条件不变,增大反应物浓度是通过增大活化分子百分数,使化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
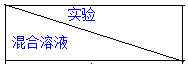 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
| 压强(kPa) | 200 | 500 | 1 000 |
| B的浓度(mol•L-1) | 0.04 | 0.1 | 0.27 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装 置 | 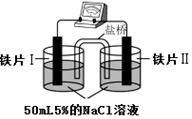 | 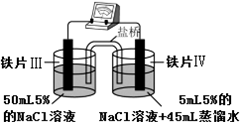 |
| 现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
| A. | “电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 | |
| B. | 铁片Ⅳ的电极反应式可能为Fe-3e-=Fe3+ | |
| C. | 用K3Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断装置的正、负极 | |
| D. | 铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,所以二者的腐蚀速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1的纯碱溶液中含有0.1NA个Na+ | |
| B. | 常温常压下,23g NO2中含有NA个氧原子 | |
| C. | 常温常压下,22.4L CCl4含有个NACCl4分子 | |
| D. | 1molFe与足量的盐酸反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol•L-1的蔗糖溶液 | B. | 0.03mol•L-1的BaCl2溶液 | ||
| C. | 0.04mol•L-1的NaCl溶液 | D. | 0.02mol•L-1的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
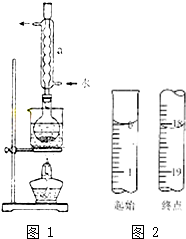 Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com