
【题目】某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3·H2O、NaCl四种溶液,按图所示步骤分开五种离子。下列判断正确的是

A.沉淀乙是氢氧化铝和氢氧化银的混合物
B.溶液3中含有Al3+
C.试剂①是NaCl,试剂④是H2SO4
D.溶液4含有三种阳离子,分别是H+、Na+、K+
【答案】C
【解析】
试题分析:从题目所给的图示步骤综合分析,可以看出第①步分离五种离子中的一种离子,只能是Ag+与Cl-结合生成AgCl沉淀.第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离.第④步用SO42-将Ba2+和K+分离,A.沉淀乙是Fe(OH)3和Al(OH)3的混合物,故A错误;B.溶液3中含有AlO2-,故B错误;C.由以上分析可知试剂①是NaCl,试剂④是H2SO4,故C正确;D.因分别加入氨水、氯化钠、硫酸,溶液4含有四种阳离子,分别是H+、Na+、K+、NH4+,故D错误;故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
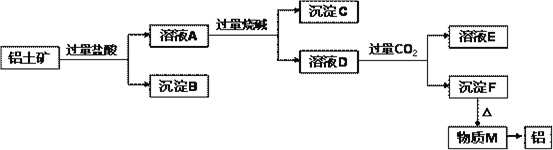
请回答下列问题:
⑴图中涉及分离溶液与沉淀的实验方法是__________(填操作名称)。
⑵沉淀B的成分是___________(填化学式,下同);沉淀C的成分是___________;溶液D中大量存在的阴离子是___________。
⑶沉淀F转化为物质M的化学方程式为___________;由物质M制取铝的化学方程式为___________;溶液D中通入过量CO2生成沉淀F的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比( )
A. 5:2 B. 15:2 C. 3:1 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. T2时,NO2的平衡转化率为70.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把a mol C2H4跟b mol H2在密闭容器中,在适当条件下,反应达到平衡时生成了p mol C2H6 , 若将所得平衡混合气体混合气体,生成CO2和H2O,所需氧气的物质的量应是( )
A.(3a+0.5b)mol
B.(3a+0.5b)mol
C.(3a+0.5b+3p)mol
D.(3a+0.5b﹣3p)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某核素AZX可形成HmX型氢化物,则agHmX含有( )
A.![]() (Z+m)mol 质子
(Z+m)mol 质子
B.![]() (Z+m)mol 电子
(Z+m)mol 电子
C.![]() (A﹣Z+m)mol 中子
(A﹣Z+m)mol 中子
D.![]() ?mmolHmX
?mmolHmX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某混合物的无色溶液中,可能含有以下离子中的若干种:K+、Ca2+、Fe3+、NH4+、Cl-、CO32-和SO42-。现每次取10.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下);
③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g。
(1)c(CO32-)=______mol·L1;
(2)某同学认为该溶液中一定存在K+,浓度范围是_________________;
(3)根据以上实验,某离子可能存在。检验该离子是否存在的方法是___________________________;
(4)写出③中固体加入足量盐酸洗涤的离子方程式________________________________。
Ⅱ.四种物质有如下相互转化关系:
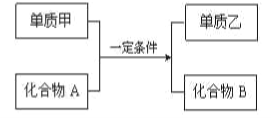
(5)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为____________________;
(6)若甲是活泼金属,化合物B是强碱,则该反应的离子方程式为____________;
(7)若乙是黑色固体,化合物B是优质的耐高温材料。则该反应的化学方程式为____________________;
(8)若化合物A可作光导纤维材料,乙是一种重要的半导体材料。则该反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为长式周期表的一部分,其中的编号代表对应的元素. 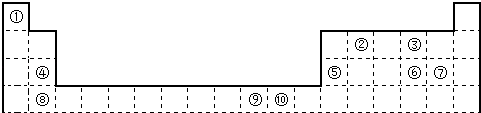
请回答下列问题:
(1)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为(用对应的元素符号表示).
(2)某元素的价电子排布式为nsnnpn+1 , 该元素与元素①形成的18电子的X分子的结构式为;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为 .
(3)比较③,⑤,⑥,⑦,⑧五种元素的电负性大小,由大到小排列的顺序为(用 元素符号表示).
(4)⑩元素单质晶体采取堆积方式 , 空间利用率为 . 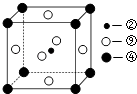
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com