
分析 (1)根据化合价规则结合氧元素的化合价是-2价来计算Fe的化合价;
(2)锰元素的最高价是+7价,根据化合价规则书写化学式,可以和碱反应生成盐和水的氧化物属于酸性氧化物;
(3)用电解锰酸钾(K2MnO4)溶液的方法制备KMnO4,在阴极上发生还原反应,阳极上发生氧化反应;
(4)由①3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-46.97kJ•mol-1;
②Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19.3kJ•mol-1;
$\frac{①+②×2}{3}$得到Fe2O3(s)+CO(g)=2FeO(s)+CO2(g),根据盖斯定律计算焓变.
解答 解:(1)氧元素的化合价是-2价,根据化合价规则,Fe的化合价是+8价,故答案为:+8;
(2)锰元素的最高价是+7价,Mn的最高价氧化物的化学式为Mn2O7,Mn2O7可以和碱反应生成盐和水,属于酸性氧化物,故答案为:Mn2O7;酸性;
(3)用电解锰酸钾(K2MnO4)溶液的方法制备KMnO4,在阴极上发生还原反应,2H++2e-=H2↑,阳极上发生氧化反应;MnO42--e-=MnO4-;
故答案为:H2;MnO42--e-=MnO4-;
(4)由①3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-46.97kJ•mol-1;
②Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19.3kJ•mol-1;
$\frac{①+②×2}{3}$得到Fe2O3(s)+CO(g)=2FeO(s)+CO2(g),根据盖斯定律焓变=$\frac{-46.97+2(+19.3)}{3}$kJ•mol-1=-2.79kJ•mol-1;故答案为:-2.79.
点评 本题考查电极反应方程式的书写及有关氧化还原反应的计算、焓变的计算,明确反应物与生成物及物质之间的关系是解答的关键,难度中等.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳-14核素:${\;}_8^{14}C$ | B. | Ca2+的结构示意图为 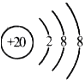 | ||
| C. | 氮气的电子式 | D. | HCIO的结构式为H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
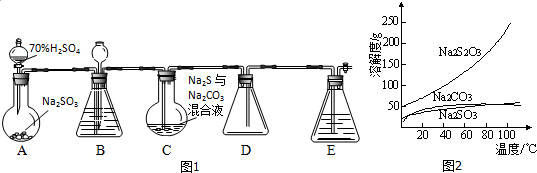
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
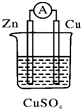
| A. | 电流从锌电极通过电流表流向铜电极 | |
| B. | 锌电极发生还原反应,铜电极发生氧化反应 | |
| C. | 当有13 g Zn溶解时,外电路中就有0.4 mol电子通过 | |
| D. | 铜电极作正极,发生的电极反应为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
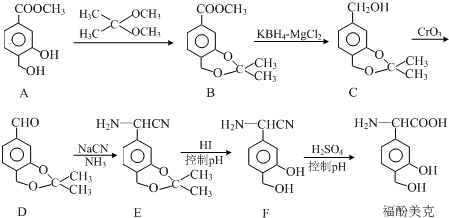
 .
.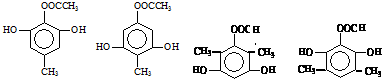 任意一种.
任意一种.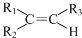 $→_{②Zn/H_{20}}^{①O_{3}}$
$→_{②Zn/H_{20}}^{①O_{3}}$ 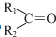 +R3CHO,根据已有知识并结合相关信息,写出以
+R3CHO,根据已有知识并结合相关信息,写出以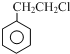 为原料制备
为原料制备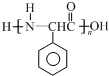 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com