
分析 (1)①H3PO2是一元中强酸,在水溶液里部分电离生成氢离子和酸根离子;
②A.NaH2PO2溶液中H2PO2-是弱酸阴离子,水解溶液显弱碱性;
B.向NaH2PO2溶液中滴加硝酸可以制得H3PO2,H3PO2 具有较强的还原性易被硝酸氧化;
C.H3PO2是一元酸;
D.NaH2PO2溶液中存在物料守恒;
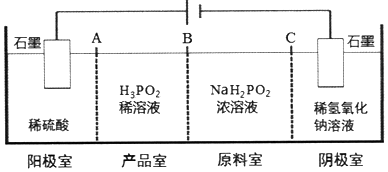
(2)①根据阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,判断放电能力强弱,然后写出阳极的电极反应式;
②根据图示“四室电渗析法”工作原理分析产品室可得到H3PO2的原因,判断为A为阳离子交换膜,B为阴离子交换膜,C为阳离子交换膜;
③由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:2H2O-4e-=O2↑+4H+;
解答 解:(1)①H3PO2是一元中强酸,在水溶液里部分电离生成氢离子和酸根离子,电离方程式为H3PO2?H++H2PO2-,
故答案为:H3PO2?H++H2PO2-;
②A.NaH2PO2溶液中H2PO2-是弱酸阴离子,水解结合水中氢离子生成次磷酸,促进水的电离,溶液中氢氧根离子浓度增大,溶液显弱碱性,故A正确;
B.H3PO2 具有较强的还原性易被硝酸氧化,向NaH2PO2溶液中滴加硝酸不可以制得H3PO2,故B错误;
C.H3PO2是一元酸,lmolH3PO2最多可以和1molNaOH发生反应,故C错误;
D.H3PO2是一元中强酸,NaH2PO2溶液中存在物料守恒,c(Na+)=c(H3PO2)+c(H2PO2-),故D正确;
故答案为:AD;
(2)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:2H2O-4e-=O2↑+4H+,
故答案为:2H2O-4e-=O2↑+4H+;
②产品室可得到H3PO2的原因是因为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2,A为阳离子交换膜,B为阴离子交换膜,C为阳离子交换膜,
故答案为:阳、阴、阳;
③由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:2H2O-4e-=O2↑+4H+,溶液PH变小,
故答案为:变小.
点评 本题考查氧化还原反应、电离方程式的书写、盐类水解、电解过程的分析判断等知识点,明确物质的性质是解本题关键,i注意H3PO2属于一元中强酸,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、HCO3-、NO3- | B. | NH4+、A13+、SO42-、NO3- | ||
| C. | K+、Fe2+、NH4+、NO3- | D. | NH4+、Na+、NO3-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数发生了改变 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变了压强 | |
| C. | 正逆反应速率发生了改变 | |
| D. | 有固态物质参加的可逆反应达到平衡后,移走适量的固态物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水中加盐酸:2H++Ca(OH)2═Ca2++2H2O | |
| B. | 向NaHCO3溶液中加入NaOH溶液:HCO3-+OH-═CO32-+H2O | |
| C. | 氯气溶于水:Cl2+H2O?2H++ClO-+Cl- | |
| D. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量使用化肥农药,提高粮食产量 | |
| B. | 建设三峡大坝使用了大量水泥,水泥是硅酸盐材料 | |
| C. | 汽车安装尾气转化装置可以减少NO、CO等污染物的排放 | |
| D. | 开发新能源,减少对化石能源的依赖,也能减少对大气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.1mol/(L•min) | B. | v(NH3)=0.3mol/(L•min) | ||
| C. | v(N2)=0.2mol/(L•min) | D. | v(H2)=0.3mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com