

分析 闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)中加硫酸和Fe2(SO4)3,硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫,CdS、Fe2O3溶于硫酸形成离子,过滤,得到的滤渣为S,滤液中加Fe,三价铁离子被还原为亚铁离子,浓缩结晶得到FeSO4•7H2O,再通空气除去剩余的Fe,再加人还原剂把Cd2+还原为单质,过滤,蒸发浓缩滤液得到ZnSO4•7H2O,
(1)硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫;
(2)加入硫酸铁和硫酸是为了溶解氧化铁、硫化锌、硫化镉获得生产硫酸锌晶体和硫酸亚铁晶体的原料,其中硫酸铁氧化硫化锌;
(3)除铁是利用双氧水将亚铁离子氧化成铁离子,再调节pH值使铁离子沉淀完全,调节溶液PH不能引入新的杂质;
(4)依据置换反应的反应条件是活泼金属进行置换,结合制备实验方案是制取ZnSO4•7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间分析;
(5)28.70 g ZnSO4•7H2O的物质的量为0.1mol,分别分析生成ZnO、ZnSO4、ZnSO4•H2O的质量,进而确定温度.
解答 解:闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)中加硫酸和Fe2(SO4)3,硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫,CdS、Fe2O3溶于硫酸形成离子,过滤,得到的滤渣为S,滤液中加Fe,三价铁离子被还原为亚铁离子,浓缩结晶得到FeSO4•7H2O,再通空气除去剩余的Fe,再加人还原剂把Cd2+还原为单质,过滤,蒸发浓缩滤液得到ZnSO4•7H2O,
(1)依据流程转化关系分析判断,加入的硫酸铁具有氧化性能溶解氧化硫化锌、硫化镉,从滤渣A中可获得一种淡黄色非金属单质的副产品为氧化产物为硫,
故答案为:S;
(2)依据流程反应和生成硫单质可知,硫酸铁具有氧化性能氧化硫化锌和硫化镉,生成单质硫,反应的化学方程式为:Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S,
故答案为:Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S;
(3)除铁是利用双氧水将亚铁离子氧化成铁离子,再调节pH值使铁离子沉淀完全,所以除铁过程加H2O2的目的是将Fe2+氧化为Fe3+便于形成沉淀而除去,调节溶液PH,加入的且物质和酸反应不能引入新的杂质,A.ZnO B.ZnCO3 C.Zn(OH)2都可以和酸反应 且不引入新杂质,D.NaOH会引入钠离子,故选ABC,
故答案为:将Fe2+氧化为Fe3+便于形成沉淀而除去;ABC;
(4)制备实验方案是制取ZnSO4•7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间,所以加入锌可以置换镉,
故答案为:Zn;
(5)28.70 g ZnSO4•7H2O的物质的量为0.1mol,若得ZnSO4•H2O的质量为17.90g,则温度为100℃;若得ZnSO4的质量为16.10g,则温度为250℃;若得ZnO的质量为8.10g,则温度为930℃;据此通过排除法确定680℃时所得固体的化学式为Zn3O(SO4)2;
故答案为:b.
点评 本题综合考查物质的制备、分离、提纯等知识,侧重于学生的分析能力、实验能力和计算能力的考查,把握物质性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 单位体积内活化分子数增多 | B. | 活化分子百分含量增多 | ||
| C. | 单位体积内活化分子数不变 | D. | 活化分子百分含量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
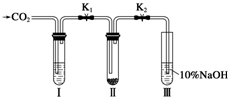 某课题研究小组的同学在查阅资料时得知,Na2O2与干燥的CO2不能发生反应,当有少量水存在时,Na2O2可与CO2发生反应生成Na2CO3和O2.为了探究“二氧化碳是否在有水存在时才能与过氧化钠反应”.某课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
某课题研究小组的同学在查阅资料时得知,Na2O2与干燥的CO2不能发生反应,当有少量水存在时,Na2O2可与CO2发生反应生成Na2CO3和O2.为了探究“二氧化碳是否在有水存在时才能与过氧化钠反应”.某课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积不变,增加H2O(g)的量 | |
| B. | 保持体积不变,充入Ne使体系压强增大 | |
| C. | 将容器的体积缩小一半 | |
| D. | 压强不变,充入He使容器的体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ③④⑤ | C. | ③④⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L四氯化碳所含分子数为0.5 NA | |
| B. | 1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 80g硝酸铵含有氮原予数为2NA | |
| D. | 1mol氯气和铁反应时转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCN为V形分子 | |
| B. | NO3-的空间构型为三角锥形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SO42-和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com