
| A. | NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 | |
| B. | 在NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| C. | pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等 | |
| D. | 0.1 mol/L 的NaOH溶液和CH3COOH溶液等体积混合,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
分析 A、氯化铵溶液稀释促进水解,但离子浓度减小,溶液酸性减弱PH增大,温度不变离子积不变;
B、碳酸氢钠溶液中存在电荷守恒和物料守恒,合并计算分析选项;
C、溶液中,c(H+)=10-pH;
D、0.1 mol/L 的NaOH溶液和CH3COOH溶液等体积混合得到醋酸钠溶液,醋酸根离子水解显碱性.
解答 解:A、氯化铵溶液稀释促进水解,但离子浓度减小,溶液中氢离子浓度减小,酸性减弱PH增大,温度不变离子积常数不变,故A错误;
B、在碳酸氢钠溶液中,碳酸氢钠放电电离和水解,其溶液中存在电离平衡和水解平衡,NaHCO3=Na++HCO3-、HCO3-?H++CO32-、HCO3--H2O?H2CO3+OH-,溶液中存在电荷守恒、物料守恒,根据电荷守恒得C(H+)+C(Na+)=c(OH-)+C(HCO3-)+2C(CO32-),根据物料守恒得C(HCO3-)+C(CO32-)+C(H2CO3)=C(Na+),合并计算得到c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故B正确;
C、pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)=10-pH,两种溶液的pH相等,所以其c(H+)相等,故C正确;
D、0.1 mol/L 的NaOH溶液和CH3COOH溶液等体积混合得到醋酸钠溶液,醋酸根离子水解溶液显碱性,离子浓度大小c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确;
故选A.
点评 本题考查了盐类水解的应用判断,影响水解平衡的因素分析,溶液中离子积的计算,PH的计算,溶液稀释后离子浓度变化的分析判断,理解实质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2?N2O4-----①N2O4?2NO2--②,反应①的化学平衡常数是反应②的化学平衡常数的倒数 | |
| B. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol将0.05mol/LBa(OH)2溶液100.0mL与0.05mol/LH2SO4溶液100.0mL混合,在298K101kPa条件下放热量为0.573kJ | |
| C. | 已知298K 时,0.10mol/L HAc的电离度为1.32%.在0.10mol/L HAc 和0.10mol/LNaAc的混合溶液20.00mL中,有如下变化: HAc?H++Ac----①,NaAc=Na++Ac-----②,Ac-+H2O?HAc+OH-----③,向该溶液中滴入几滴稀盐酸,溶液的pH保持相对稳定 | |
| D. | 将明矾与纯碱溶液混合,有沉淀产生,该沉淀的成分为碳酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 断开lmol H-H键需要的能量大于断开1mol Cl-Cl键需要的能量 | |
| B. | 反应H2+C12=2HCl在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能大于反应②的活化能 | |
| D. | 已知反应②的△H>O,则反应③的△H一定小于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温时,NaHA溶液pH<7,是由于HA-的电离程度大于其水解程度 | |
| B. | 在0.1 mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1 mol/L | |
| C. | 在0.1 mol/L的NaHA溶液中,一定有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 向两份等体积NaHA、Na2A的浓度比为1:1的混合溶液中分别加入适当浓度的盐酸与氢氧化钠,其pH随加入酸、碱量的变化图象为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )| A. | X元素最高价氧化物对应水化物的酸性弱于Y元素的 | |
| B. | Y元素气态氢化物的稳定性大于Z元素的 | |
| C. | 元素Z在周期表中的位置为第2周期、VIA族 | |
| D. | M元素的氧化物既可以与强酸溶液反应,也可以与强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BeCl2分子的电子式: | |
| B. | 质子数为116,中子数为177的鉝(Lv)原子:${\;}_{116}^{293}$Lv | |
| C. | 氯离子的结构示意图: | |
| D. | 苯甲醇的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 互为同分异构体 | B. | 均能与Na反应且产物相同 | ||
| C. | 均可发生取代反应和加成反应 | D. | 分子中共平面的碳原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
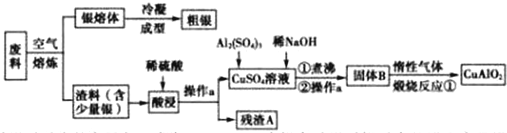
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com