
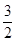 C(s)=
C(s)=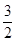 CO2(g)+2Fe(s);△H=+234.1kJ/mol
CO2(g)+2Fe(s);△H=+234.1kJ/mol 2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为 mol/(L·h).
2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为 mol/(L·h). Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.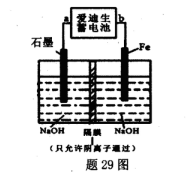
 O2(g) = Fe2O3(s) △H=-824.4kJ/mol(3分)
O2(g) = Fe2O3(s) △H=-824.4kJ/mol(3分) O2(g) = Fe2O3(s) ,所以反应热是-393.5kJ/mol×3/2-234.1kJ/mol=-824.4kJ/mol.
O2(g) = Fe2O3(s) ,所以反应热是-393.5kJ/mol×3/2-234.1kJ/mol=-824.4kJ/mol.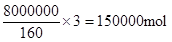 ,所以其反应速率是
,所以其反应速率是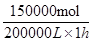 =0.75mol/(L·h)。
=0.75mol/(L·h)。 FeO42-+3H2↑可知,消耗1.6molOH-,但同时生成0.8molFeO42-,所以结束阴离子是0.8mol。
FeO42-+3H2↑可知,消耗1.6molOH-,但同时生成0.8molFeO42-,所以结束阴离子是0.8mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.先滴加氯水,再滴加KSCN溶液后显红 |
| B.只需滴加KSCN溶液 |
| C.先滴加KSCN溶液,不显红色,再滴加氯水后显红色 |
| D.加Na2O2固体后观察沉淀颜色的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.1:2 | C.2:1 | D.2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
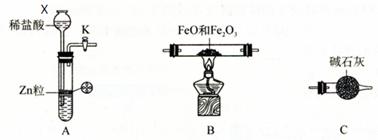
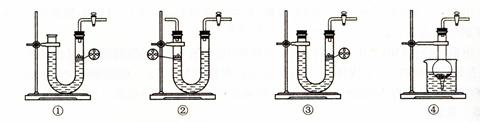
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
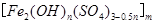 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下: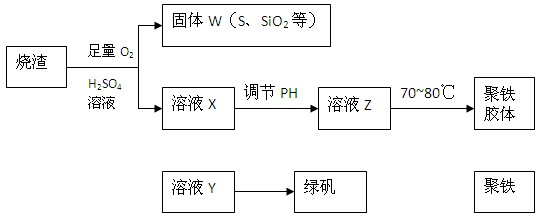
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.酸性 | B.氧化性 | C.酸性和氧化性 | D.还原性 |
 mol;
mol; ol(用含a的式子表示);
ol(用含a的式子表示); 2NaNO2+H2O
2NaNO2+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com