
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2,30%) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
| ||
| ||


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:不详 题型:问答题
| 混合物 | 试剂 | 分离方法 | 主要仪器 |
| 甲烷(乙烯) | ______ | ______ | ______ |
| 乙酸乙酯(乙酸) | ______ | ______ | ______ |
| 肥皂(甘油) | ______ | ______ | ______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 |
| B.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②<③ |
| D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol |
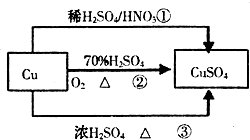
查看答案和解析>>
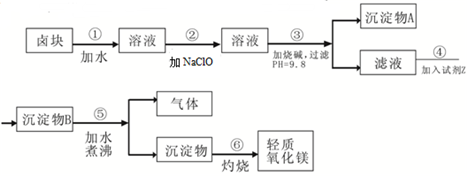
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
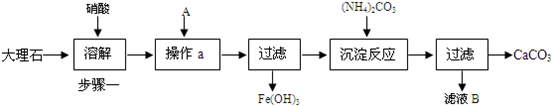
查看答案和解析>>
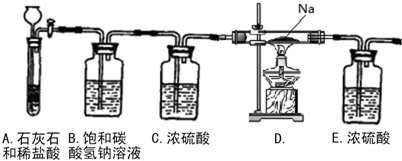
科目:高中化学 来源:不详 题型:实验题
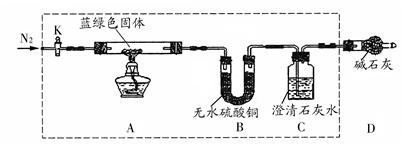
查看答案和解析>>
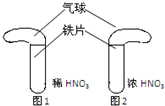
科目:高中化学 来源:不详 题型:实验题
| A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液直接蒸干 |
| D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上 |
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com