下列判断中一定正确的是( )
A.等物质的量的CaCl2及CaO2固体中阴、阳离子数之比均为2:1
B.等质量的O2与O3中,氧原子的个数比为3:2
C.分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2
D.10mL 0.3mol?L-1NaCl与30mL0.1mol?L-1AlCl3溶液中Cl-物质的量浓度比为1:3
【答案】
分析:A.CaO
2固体中阴、阳离子数之比为1:1;
B.根据n=

及物质的构成来分析;
C.由2H
2O
2~O
2、2KMnO
4~O
2来分析;
D.NaCl溶液中Cl
-物质的量浓度为0.3mol/L,AlCl
3溶液中Cl
-物质的量浓度为0.1mol/L×3.
解答:解:A.CaO
2固体中阴、阳离子数之比为1:1,CaCl
2中阴、阳离子数之比为2:1,故A错误;
B.O
2与O
3中均由氧原子构成,质量相同,由n=
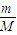
可知,氧原子的物质的量相同,所以等质量的O
2与O
3中氧原子的个数比为1:1,故B错误;
C.由2H
2O
2~O
2、2KMnO
4~O
2可知,当制得等质量O
2时,若均为1mol,则转移电子数之比为1mol×2×(1-0):1mol×2×(2-0)=1:2,故C正确;
D.NaCl溶液中Cl
-物质的量浓度为0.3mol/L,AlCl
3溶液中Cl
-物质的量浓度为0.1mol/L×3=0.3mol/L,所以Cl
-物质的量浓度比为1:1,故D错误;
故选C.
点评:本题为小综合,注重对物质的构成、物质的量的有关计算、氧化还原反应中电子转移的计算的考查,熟悉元素的化合价变化是解答C选项的关键,题目难度不大.

 及物质的构成来分析;
及物质的构成来分析;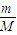 可知,氧原子的物质的量相同,所以等质量的O2与O3中氧原子的个数比为1:1,故B错误;
可知,氧原子的物质的量相同,所以等质量的O2与O3中氧原子的个数比为1:1,故B错误;
