
下列各选项所描述的两个量中,前者一定大于后者的是()
A. pH=3的盐酸的Cl﹣浓度和pH=3的醋酸溶液的CH3COO﹣浓度
B. pH相同的氨水和醋酸钠溶液中,由水电离产生的c(H+)
C. 0.1mol/L的盐酸和0.1mol/L的醋酸分别与金属镁反应的速率
D. pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH
考点: 弱电解质在水溶液中的电离平衡;化学反应速率的影响因素;pH的简单计算.
专题: 电离平衡与溶液的pH专题.
分析: A、pH=3的盐酸的Cl﹣浓度和pH=3的醋酸溶液氢离子浓度相等,醋酸中氢离子的浓度和醋酸根离子浓度近似相等;
B、氨水对水的电离起到抑制作用,醋酸钠对水的电离起到促进作用;
C、盐酸是强酸,能完全电离,醋酸是弱酸,不完全电离;
D、氢氧化钠是强碱,氨水是弱碱,存在电离平衡,加水会促进平衡正向移动.
解答: 解:A、pH=3的盐酸的Cl﹣浓度和pH=3的醋酸溶液氢离子浓度相等,氯离子浓度和和醋酸根离子浓度近似相等,故A错误;
B、氨水对水的电离起到抑制作用,醋酸钠对水的电离起到促进作用,由水电离产生的c(H+)前者一定小于后者,故B错误;
C、盐酸是强酸,能完全电离,醋酸是弱酸,不完全电离,0.1mol/L的盐酸中氢离子浓度比0.1mol/L的醋酸中氢离子浓度大,分别与金属镁反应的速率前者一定大于后者,故C正确;
D、氢氧化钠是强碱,pH=11的NaOH稀释100倍后,pH变为9,氨水是弱碱,存在电离平衡,加水会促进平衡正向移动,稀释100倍后,pH大于9,即前者小于后者,故D错误.
故选C.
点评: 本题涉及弱电解质的电离平衡以及化学反应速率的影响因素、溶液稀释后pH的计算等知识,难度不大,综合性强.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 |
|
| B. | 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH |
|
| C. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
|
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol•L﹣1.
(2)取用任意体积的该盐酸溶液时,下列物理量中,不随取用的体积多少而变化的是 .
A.HCl的摩尔质量 B.溶液的浓度
C.溶液中Cl﹣的质量分数 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制480mL 物质的量浓度为0.4mol•L﹣1的稀盐酸.
①该学生需选择容量瓶的规格为 mL;(填:100、250、500、1000)
该学生需要量取 ml 上述浓盐酸进行配制.
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
Ⅰ.用量筒量取浓盐酸时,俯视观察凹液面
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(填:“偏大”、“偏小”或“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
有下列七种物质:①甲烷、②苯、③聚乙烯、④聚乙炔、⑤2﹣丁炔、⑥环己烷、⑦环己烯,既能使酸性高锰酸钾溶液退色,又能使溴水因反应而退色的是()
A. ②③④⑤ B. ③④⑤⑦ C. ④⑤⑥ D. ④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活和社会密切相关.下列说法不正确的是()
A. 漂白粉长期暴露在空气中会变质失效
B. 雾霾天车灯照射的光亮通路属于丁达尔现象
C. 硬铝属于合金材料,瓷器属于硅酸盐制品
D. 不锈钢具有较强的抗腐蚀性,是因为在钢铁表面镀上了金属铬
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是一种对甘蔗渣进行废物利用的设想:
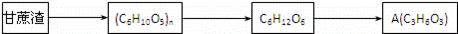
(1)已知A能与NaHCO3溶液反应产生气泡,1molA和足量的金属钠反应产生22.4L(标准状况下)H2,则A分子中含有的含氧官能团的名称是 .
(2)以A为原料可以制取一种常见树脂M:
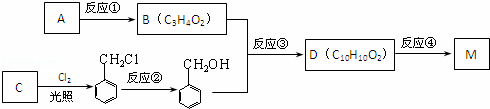
①C、M的结构简式分别为:C M ;
②反应①的反应类型为 ;
③反应②所加的试剂是 ;
④反应③的化学反应方程式为 ;
⑤D有多种同分异构体,其中有一类符合下列条件:
(a)苯环上有2个取代基且处于对位
(b)能使FeCl3溶液显色
(c)能发生银镜反应
请写出符合上述条件的一种有机物的结构简式: 等.
查看答案和解析>>
科目:高中化学 来源: 题型:
碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
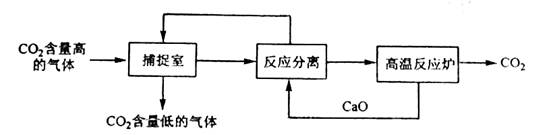
下列有关该方法的叙述中正确的是
A.能耗大是该方法的一大缺点
B.整个过程中,只有一种物质可以循环利用
C.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
查看答案和解析>>
科目:高中化学 来源: 题型:
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH = ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为________________.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl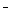 、OH
、OH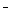 和SO
和SO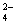 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
① 提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO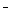 ;假设3:_____________.
;假设3:_____________.
② 设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3 moL | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
在石灰窑中烧制生石灰,1 mol CaCO3完全分解所需要的能量,可燃烧0.453 mol碳来提供。设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数可能是( )
A.0.43 B.0.46 C.0.49 D..0.52
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com