
ЁОЬтФПЁПНќФъРДЃЌЮЊгІЖдЮТЪвЦјЬхХХЗХЮЪЬтКЭШевцдіГЄЕФФмдДашЧѓЮЪЬтЃЌCO2злКЯРћгУММЪѕзїЮЊЧБдкЕФНтОіЗНАИЪмЕНСЫбаОПепЕФЙуЗКЙизЂЁЃЧыАДеевЊЧѓЛиД№ЮЪЬт
ЃЈ1ЃЉCOГЃгУгкЙЄвЕвБСЖН№ЪєЃЌЯТЭМЪЧдкВЛЭЌЮТЖШЯТCOЛЙдЫФжжН№ЪєбѕЛЏЮяДяЦНКтКѓЦјЬхжа![]() гыЮТЖШЃЈtЃЉЕФЙиЯЕЧњЯпЭМЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ________ЁЃЃЈЬюађКХЃЉ
гыЮТЖШЃЈtЃЉЕФЙиЯЕЧњЯпЭМЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ________ЁЃЃЈЬюађКХЃЉ

A ЙЄвЕЩЯПЩвдЭЈЙ§діИпЗДгІзАжУРДбгГЄПѓЪЏКЭCOНгДЅЕФЪБМфЃЌМѕЩйЮВЦјжаCOЕФКЌСП
B COВЛЪЪвЫгУгкЙЄвЕвБСЖН№ЪєИѕЃЈCrЃЉ
C ЙЄвЕвБСЖН№ЪєЭЃЈCuЃЉЪБНЯЕЭЕФЮТЖШгаРћгкЬсИпCOЕФРћгУТЪ
D COЛЙдPbO2ЕФЗДгІЁїH>0
ЃЈ2ЃЉвЛЖЈЬѕМўЯТPdЃMg/SiO2ДпЛЏМСПЩЪЙCO2 ЁАМзЭщЛЏЁББфЗЯЮЊБІ ЃЌзюМбДпЛЏЮТЖШЪЧ200ЁцЁЋ300ЁцзѓгвЃЌГЌЙ§300ЁцДпЛЏМСЛсЭъШЋЪЇЛюЁЂЗДгІЭЃжЙЁЃЯђУмБеШнЦїЭЈШыvЃЈCO2ЃЉЃКvЃЈH2ЃЉЃН1ЃК4ЕФЗДгІЦјЬхЃЌГЃЮТНјСЯПЊЪММгШШЃЌЛГіЩњГЩМзЭщЕФСПЫцЮТЖШЕФБфЛЏЧњЯп_________ЁЃ
ЃЌзюМбДпЛЏЮТЖШЪЧ200ЁцЁЋ300ЁцзѓгвЃЌГЌЙ§300ЁцДпЛЏМСЛсЭъШЋЪЇЛюЁЂЗДгІЭЃжЙЁЃЯђУмБеШнЦїЭЈШыvЃЈCO2ЃЉЃКvЃЈH2ЃЉЃН1ЃК4ЕФЗДгІЦјЬхЃЌГЃЮТНјСЯПЊЪММгШШЃЌЛГіЩњГЩМзЭщЕФСПЫцЮТЖШЕФБфЛЏЧњЯп_________ЁЃ
ЃЈ3ЃЉдкдиШЫКНЬьЦїжагІгУЕчЛЏбЇдРэЃЌвдPtЮЊбєМЋЃЌPbЃЈCO2ЕФдиЬхЃЉЮЊвѕМЋKHCO3ШмвКЮЊЕчНтжЪШмвКЃЌЛЙдЯћГ§КНЬьЦїФкCO2ЭЌЪБВњЩњO2КЭаТЕФФмдДCOЃЌдђвѕМЋЕФЕчМЋЗДгІЪНЮЊ___________ЃЛЪвЮТЯТH2CO3ЕчРыГЃЪ§дМЮЊK1ЃН4ЁС10Ѓ7ЃЌK2ЃН5ЁС10Ѓ11ЃЌдђ0.025 molЁЄLЃ1ЕФH2CO3ШмвКЕФpHдМЕШгк__________ЃЈВЛПМТЧЕкЖўВНЕчРыКЭH2OЕФЕчРыЃЉ
ЁОД№АИЁПBC  H2OЃЋ3CO2ЃЋ2eЃНCOЃЋ2HCO3 4
H2OЃЋ3CO2ЃЋ2eЃНCOЃЋ2HCO3 4
ЁОНтЮіЁП
(1)AЃЎдіИпТЏЕФИпЖШЃЌдіДѓCOгыЬњПѓЪЏЕФНгДЅЃЌВЛФмгАЯьЦНКтвЦЖЏЃЛ
BЃЎгЩЭМПЩжЊгУCOЙЄвЕвБСЖН№ЪєИѕЪБЃЌlg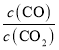 вЛжБКмИпЃЌЫЕУїCOзЊЛЏТЪКмЕЭЃЛ
вЛжБКмИпЃЌЫЕУїCOзЊЛЏТЪКмЕЭЃЛ
CЃЎгЩЭМЯѓПЩжЊЮТЖШдНЕЭlg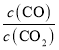 дНаЁЃЛ
дНаЁЃЛ
DЃЎгЩЭМПЩжЊCOЛЙдPbO2ЕФЮТЖШдНИпlg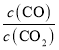 дНИпЃЌЫЕУїCOзЊЛЏТЪдНЕЭЃЛ
дНИпЃЌЫЕУїCOзЊЛЏТЪдНЕЭЃЛ
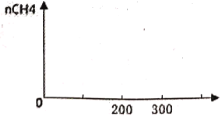
(2)зюМбДпЛЏЮТЖШЪЧ200ЁцЁЋ300ЁцзѓгвЃЌЗДгІЫйТЪДѓЃЌЩњГЩМзЭщЖрЃЌЖјГЌЙ§300ЁцДпЛЏМСЛсЭъШЋЪЇЛюЁЂЗДгІЭЃжЙЃЌЩњГЩМзЭщЕФСПБЃГжВЛБфЃЛ
(3)вѕМЋЩЯЖўбѕЛЏЬМЕУЕНЕчзгЩњГЩCOКЭЬМЫсЧтИљРызгЃЛЪвЮТЯТH2CO3ЕчРыГЃЪ§дМЮЊK1ЃН4ЁС107ЃЌВЛПМТЧЕкЖўВНЕчРыКЭH2OЕФЕчРыЃЌдђc(HЃЋ)ЃН0.025ЁС4ЁС107mol/LЃН104mol/LЁЃ
(1)AЃЎдіИпТЏЕФИпЖШЃЌдіДѓCOгыЬњПѓЪЏЕФНгДЅЃЌВЛФмгАЯьЦНКтвЦЖЏЃЌCOЕФРћгУТЪВЛБфЃЌВЛФмМѕЩйЮВЦјжаCOКЌСПЃЌЙЪAДэЮѓЃЛ
BЃЎгЩЭМЯѓПЩжЊгУCOЙЄвЕвБСЖН№ЪєИѕЪБЃЌlg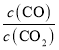 вЛжБКмИпЃЌЫЕУїCOзЊЛЏТЪКмЕЭЃЌЙЪВЛЪЪКЯЃЌЙЪBе§ШЗЃЛ
вЛжБКмИпЃЌЫЕУїCOзЊЛЏТЪКмЕЭЃЌЙЪВЛЪЪКЯЃЌЙЪBе§ШЗЃЛ
CЃЎгЩЭМПЩжЊЮТЖШдНЕЭЃЌlg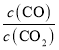 дНаЁЃЌЙЪCOзЊЛЏТЪдНИпЃЌЙЪCе§ШЗЃЛ
дНаЁЃЌЙЪCOзЊЛЏТЪдНИпЃЌЙЪCе§ШЗЃЛ
DЃЎгЩЭМПЩжЊCOЛЙдPbO2ЕФЮТЖШдНИпЃЌlg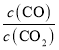 дНИпЃЌЫЕУїCOзЊЛЏТЪдНЕЭЃЌЦНКтФцЯђвЦЖЏЃЌЙЪЁїHЃМ0ЃЌЙЪDДэЮѓЃЛ
дНИпЃЌЫЕУїCOзЊЛЏТЪдНЕЭЃЌЦНКтФцЯђвЦЖЏЃЌЙЪЁїHЃМ0ЃЌЙЪDДэЮѓЃЛ
ЙЪД№АИЮЊЃКBCЃЛ
(2)ГЃЮТНјСЯПЊЪММгШШЃЌЫцзХЮТЖШЩ§ИпЃЌЗДгІНјГЬМгПьЃЌn(CH4)діМгЃЌЮТЖШЩ§ИпЕН200Ёц300ЁцзѓгвЪБЃЌn(CH4)діМгНЯПьЃЌЕЋЮТЖШГЌЙ§300ЁцЪБДпЛЏМСЛсЭъШЋЪЇЛюЁЂЗДгІЭЃжЙЃЌМДn(CH4)ЫцЮТЖШЩ§ИпБЃГжВЛБфЃЌКсзјБъЮЊЪБМфЁЂзнзјБъЮЊМзЭщЕФЮяжЪЕФСПЃЌЩњГЩМзЭщЕФСПЫцЮТЖШЕФБфЛЏЧњЯпЮЊ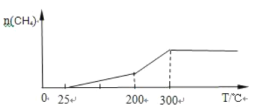 ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК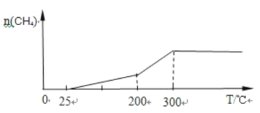 ЃЛ
ЃЛ
(3)вдPtЮЊбєМЋЃЌPb(CO2ЕФдиЬх)ЮЊвѕМЋЃЌKHCO3ШмвКЮЊЕчНтжЪШмвКЃЌзмЗДгІЮЊ2CO2![]() 2COЃЋO2ЃЌдђвѕМЋЩЯCO2ЕУЕНЕчзгЗЂЩњЛЙдЗДгІЩњГЩCOЃЌгЩЕчзгЪиКуЁЂЕчКЩЪиКуЁЂдзгЪиКуПЩжЊвѕМЋЗДгІЪНЮЊH2OЃЋ3CO2ЃЋ2eЃНCOЃЋ2HCO3ЃЛЪвЮТЯТ H2CO3ЕчРыГЃЪ§дМЮЊK1ЃН4ЁС107ЃЌВЛПМТЧЕкЖўВНЕчРыКЭH2OЕФЕчРыЃЌдђc(HЃЋ)ЃН0.025ЁС4ЁС107mol/LЃН104mol/LЃЌpHЃНlg104ЃН4ЃЌЙЪД№АИЮЊЃКH2OЃЋ3CO2ЃЋ2eЃНCOЃЋ2HCO3ЃЛ4ЁЃ
2COЃЋO2ЃЌдђвѕМЋЩЯCO2ЕУЕНЕчзгЗЂЩњЛЙдЗДгІЩњГЩCOЃЌгЩЕчзгЪиКуЁЂЕчКЩЪиКуЁЂдзгЪиКуПЩжЊвѕМЋЗДгІЪНЮЊH2OЃЋ3CO2ЃЋ2eЃНCOЃЋ2HCO3ЃЛЪвЮТЯТ H2CO3ЕчРыГЃЪ§дМЮЊK1ЃН4ЁС107ЃЌВЛПМТЧЕкЖўВНЕчРыКЭH2OЕФЕчРыЃЌдђc(HЃЋ)ЃН0.025ЁС4ЁС107mol/LЃН104mol/LЃЌpHЃНlg104ЃН4ЃЌЙЪД№АИЮЊЃКH2OЃЋ3CO2ЃЋ2eЃНCOЃЋ2HCO3ЃЛ4ЁЃ


 ЬєеН100ЕЅдЊМьВтЪдОэЯЕСаД№АИ
ЬєеН100ЕЅдЊМьВтЪдОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФЦЪЧШЫЬхжавЛжжживЊдЊЫиЃЌвЛАуЧщПіЯТЃЌФЦдМеМГЩШЫЬхжиЕФ0.15%ЁЃФЦдЊЫиЖдгІЕФЛЏКЯЮявђзщГЩгыНсЙЙаджЪВювьКмДѓЁЃ
(1)ФЦдзгКЫЭтЕчзгЙВеМОн_______ИіЙьЕРЃЌаДГіЭЌвЛжмЦкжадзгКЫЭтMВуЩЯга2ИіЮДГЩЖдЕчзгЕФдЊЫиЦфдзгзюЭтВуЕчзгХХВМЪН_______ЁЃ
(2)ТШЛЏФЦЕФШлЕуБШТШЛЏМиЕФ_______ЃЈЬюЁАИпЁБЛђЁАЕЭЁБЃЉЃЌдвђЪЧ________ЁЃ
(3)ЪЕбщЪвПЩгУХЈАБЫЎгыЧтбѕЛЏФЦЙЬЬхЗДгІжЦШЁАБЦјЃЌЪдгУЦНКтдРэЗжЮіЧтбѕЛЏФЦЕФзїгУЃК___ЁЃ
(4)ЗњЛЏФЦШмвКжаЃЌВЛДцдкЕФЮЂСЃМфзїгУСІЪЧ_________ЃЈЬюБъКХЃЉЁЃ
A.РызгМќ B.ЙВМлМќ C.Н№ЪєМќ D.ЗЖЕТЛЊСІ
(5)ПЈЫЙФЩЗЈжЦШЁН№ЪєФЦЕФдРэЪЧЃКвдЧтбѕЛЏФЦЮЊдСЯЃЌЗХШыЬњжЪШнЦїжаШлЛЏЃЌдкЯЁгаЦјЬхЕФБЃЛЄЯТЃЌвдФјЮЊбєМЋЃЌЬњЮЊвѕМЋЃЌдквѕМЋЮіГіН№ЪєФЦЁЃаДГіЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК_______ЁЃЦфжаЃЌбѕЛЏВњЮяЪЧЃК_____ЃЌШєЗДгІзЊвЦ0.8molЕчзгЃЌжСЩйЯћКФ______g NaOHЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЛњЮяЕФУќУће§ШЗЕФЪЧ
A.CH2BrCH2BrЃК1ЃЌ2ЁЊЖўфхввЭщ
B.![]() ЃК2ЁЊввЛљБћЭщ
ЃК2ЁЊввЛљБћЭщ
C.![]() ЃК3ЁЊЖЁДМ
ЃК3ЁЊЖЁДМ
D.![]() ЃКЯѕЛљБН
ЃКЯѕЛљБН
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШ§ЗњЛЏЕЊ(NF3)(ЗњжЛгаСНжжМлЬЌЃКЃ1ЃЌ0)ЪЧЮЂЕчзгЙЄвЕжагХСМЕФЕШРызгПЬЪДЦјЬхЃЌЫќдкГБЪЊЕФЛЗОГжаФмЗЂЩњЗДгІ:3NF3+5H2O![]() 2NO+HNO3+9HFЁЃЯТСагаЙиИУЗДгІЕФЫЕЗЈе§ШЗЕФЪЧ( )
2NO+HNO3+9HFЁЃЯТСагаЙиИУЗДгІЕФЫЕЗЈе§ШЗЕФЪЧ( )
A. NF3ЪЧбѕЛЏМСЃЌH2OЪЧЛЙдМС
B. Шє1mol NF3БЛбѕЛЏЃЌЗДгІзЊвЦЕчзгЪ§ЮЊ2NA
C. ШєЩњГЩ0.4molHNO3ЃЌдђзЊвЦ0.4molЕчзг
D. бѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ1ЁУ2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУДПОЛЕФCaCO3гы100mLЯЁбЮЫсЗДгІжЦШЁCO2ЃЌЪЕбщЙ§ГЬМЧТМШчЭМЫљЪО(CO2ЕФЬхЛ§вбелЫуЮЊБъзМзДПіЯТЕФЬхЛ§)ЃЌЯТСаЗжЮіе§ШЗЕФЪЧЃЈ ЃЉ
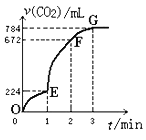
A.FЕуЪеМЏЕНЕФCO2ЕФСПзюЖр
B.OEЖЮБэЪОЕФЦНОљЫйТЪзюПь
C.EFЖЮгУбЮЫсБэЪОИУЗДгІЕФЦНОљЗДгІЫйТЪЮЊ0.4molЁЄL-1min-1
D.OEЁЂEFЁЂFGШ§ЖЮжаЃЌИУЗДгІгУЖўбѕЛЏЬМБэЪОЕФЦНОљЗДгІЫйТЪжЎБШЮЊ2ЃК6ЃК7
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2019ФъХЕБДЖћЛЏбЇНБАфИјСЫШеБОМЊвАеУЕШШ§ШЫЃЌвдБэеУЫћУЧЖдяЎРызгЕчГибаЗЂЕФзПдНЙБЯзЁЃ
(1)здШЛНчжажївЊЕФяЎПѓЮяЮЊяЎЛдЪЏЁЂяЎдЦФИЁЂЭИяЎГЄЪЏКЭСзяЎТСЪЏЕШЁЃЮЊМјЖЈФГПѓЪЏжаЪЧЗёКЌгаяЎдЊЫиЃЌПЩвдВЩгУбцЩЋЗДгІРДНјааМјЖЈЃЌЕБЙлВьЕНЛ№бцГЪ________ЃЌПЩвдШЯЮЊДцдкяЎдЊЫиЁЃ
A.зЯКьЩЋ B.зЯЩЋ C.ЛЦЩЋ
(2)ЙЄвЕжаРћгУяЎЛдЪЏ(жївЊГЩЗжЮЊLiAlSi2O6ЃЌЛЙКЌгаFeOЁЂCaOЁЂMgOЕШ)жЦБИюмЫсяЎ(LiCoO2)ЕФСїГЬШчЯТЃК
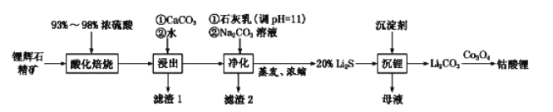
вбжЊЃКВПЗжН№ЪєЧтбѕЛЏЮяЕФpKsp(pKsp=-lgKsp)ЕФжљзДЭМШчЭМ1ЁЃ
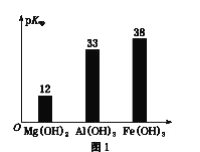
ЛиД№ЯТСаЮЪЬтЃК
ЂйяЎЛдЪЏЕФжївЊГЩЗжЮЊLiAlSi2O6ЃЌЦфбѕЛЏЮяЕФаЮЪНЮЊ________ЁЃ
ЂкЮЊЬсИпЁАЫсЛЏБКЩеЁБаЇТЪЃЌГЃВЩШЁЕФДыЪЉЪЧ________ЁЃ
ЂлЯђЁАНўГівКЁБжаМгШыCaCO3ЃЌЦфФПЕФЪЧГ§ШЅЁАЫсЛЏБКЩеЁБжаЙ§СПЕФСђЫсЃЌПижЦpHЪЙFe3+ЁЂA13+ЭъШЋГСЕэЃЌдђpHжСЩйЮЊ_______ЁЃ(вбжЊЃКЭъШЋГСЕэКѓРызгХЈЖШЕЭгк1ЁСl0-5)mol/L)
ЂмЁАГСяЎЁБЙ§ГЬЫљЛёЕУЕФЁАФИвКЁБжаШдКЌгаДѓСПЕФLi+ЃЌПЩНЋЦфМгШыЕНЁА___________ЁБВНжшжаЁЃ
ЂнLi2CO3гыCo3O4дкГЈПкШнЦїжаИпЮТЯТБКЩеЩњГЩюмЫсяЎЕФЛЏбЇЗНГЬЪНЮЊ__________
(3)РћгУяЎРызгФмдкЪЏФЋЯЉБэУцКЭЕчМЋжЎМфПьЫйДѓСПДЉЫѓдЫЖЏЕФЬиадЃЌПЊЗЂГіЪЏФЋЯЉЕчГиЃЌЕчГиЗДгІЪНЮЊLiCoO2+C6 ![]() LixC6+Li1-xCoO2 ЃЌЦфЙЄзїдРэШчЭМ2ЁЃ
LixC6+Li1-xCoO2 ЃЌЦфЙЄзїдРэШчЭМ2ЁЃ
ЯТСаЙигкИУЕчГиЕФЫЕЗЈе§ШЗЕФЪЧ___________(ЬюзжФИ)ЁЃ
AЃЎЕчГиЗДгІЪНжаЙ§ГЬ1ЮЊЗХЕчЙ§ГЬ
BЃЎИУЕчГиШєгУИєФЄПЩбЁгУжЪзгНЛЛЛФЄ
CЃЎЪЏФЋЯЉЕчГиЕФгХЕуЪЧЬсИпЕчГиЕФДЂяЎШнСПНјЖјЬсИпФмСПУмЖШ
DЃЎГфЕчЪБЃЌLiCoO2 МЋЗЂЩњЕФЕчМЋЗДгІЮЊLiCoO2-xe-=xLi++Li1-xCoO2
EЃЎЖдЗЯОЩЕФИУЕчГиНјааЁАЗХЕчДІРэЁБШУLi+ЧЖШыЪЏФЋЯЉжаЖјгаРћгкЛиЪе
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкУмБеШнЦїРяЃЌЭЈШыx mol H2ЃЈgЃЉКЭy mol I2ЃЈgЃЉЃЌЗЂЩњЗДгІЃКH2ЃЈgЃЉ+I2ЃЈgЃЉ![]() 2HIЃЈgЃЉЁїHЃМ0ЃЎИФБфЯТСаЬѕМўЃЌЗДгІЫйТЪНЋШчКЮИФБфЃПЃЈбЁЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉ
2HIЃЈgЃЉЁїHЃМ0ЃЎИФБфЯТСаЬѕМўЃЌЗДгІЫйТЪНЋШчКЮИФБфЃПЃЈбЁЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉ
ЂйЩ§ИпЮТЖШ________ЃЛ
ЂкМгШыДпЛЏМС________ЃЛ
ЂлГфШыИќЖрЕФH2________ЃЛ
ЂмБЃГжШнЦїжабЙЧПВЛБфЃЌГфШыФЪЦј________ЃЛ
ЂнБЃГжШнЦїШнЛ§ВЛБфЃЌЭЈШыФЪЦј________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПВнЫсОЇЬх(H2C2O4ЁЄ2H2O)ЮоЩЋЃЌШлЕуЮЊ101Ёц,взШмгкЫЎЃЌЪмШШЭбЫЎЁЂЩ§ЛЊ,170ЁцвдЩЯЗжНтЁЃФГбЇЩњФтгУЯТЭМзАжУзіВнЫсОЇЬхЕФЗжНтЪЕбщВЂбщжЄВПЗжВњЮяЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ
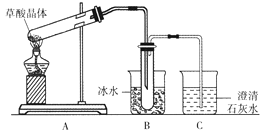
A. зАжУAжаЕФДѓЪдЙмПкгІТдЯђЯТЧуаБЃЌЪЧвђЮЊМгШШВнЫсОЇЬхЪБЛсВњЩњЫЎ
B. зАжУBЕФжївЊзїгУЪЧРфФ§(ЫЎеєЦјЁЂВнЫс)ЕШ,ЗРжЙВнЫсНјШызАжУCжа,ИЩШХCO2ЕФМьбщ
C. зАжУCжаПЩЙлВьЕНЕФЯжЯѓЪЧгаЦјХнУАГі,ГЮЧхЪЏЛвЫЎБфЛызЧ
D. БОЪЕбщФмжЄУїВнЫсОЇЬхЕФЗжНтВњЮягаЖўбѕЛЏЬМ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђЕШЮяжЪЕФСПХЈЖШЕФNaOHКЭNa2CO3ЕФЛьКЯШмвКжаМгШыЯЁбЮЫсЃЎЯТСаРызгЗНГЬЪНПЩФмгыЪТЪЕЯрЗћЕФЪЧ
A.OHЉ+2CO32Љ+3H+Ёњ2HCO3Љ+H2O
B.2OHЉ+CO32Љ+3H+ЁњHCO3Љ+2H2O
C.2OHЉ+CO32Љ+4H+ЁњCO2Ёќ+3H2O
D.OHЉ+CO32Љ+3H+ЁњCO2Ёќ+2H2O
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com