
【题目】丹参醇是存在于中药丹多中的一种天然产物。合成丹参醇的部分路线如下:

已知:![]()
回答下列问题:
(1)C中含氧官能团的名称为_______(写出其中两种)。
(2)写出B的结构简式_______。
(3)下列叙述正确的是_______。
A.D→E的反应为消去反应 B.可用金属钠鉴别D.E
C.D可与NaOH反应 D.丹参醇能发生加聚反应不能发生缩聚反应
(4)丹参醇的所有同分异构体在下列一种表征收器中显示的信号(或数据)完全相同,该仅器是______(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共探仪
(5)芳香化合物F是A的同分异构体,可与FeCl3溶液发生显色反应,F共有_____种;其中核磁共振氢谱为四组峰,峰面积比为6:2:1:1的结构简式为______(写一种即可)。
(6)写出以![]() 和
和 为原料制备
为原料制备![]() 的合成路线流程图__________________(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
的合成路线流程图__________________(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
【答案】羟基、羰基、醚键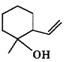 ABc9
ABc9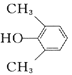 或
或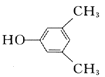
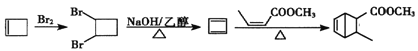
【解析】
本题考查的是有机推断和合成,有一定的难度。
(1)观察C的结构可知,含有羟基、羰基、醚键;(2)根据已知信息分析,两种烯烃可以通过加成反应形成环,故B的结构为  ; (3) A.D→E的反应过程中羟基和邻位碳上的氢原子下去,形成碳碳双键,反应为消去反应,故正确;B.D中含有羟基,而E没有,所以可以用金属钠鉴别D.E,故正确;C.D含有羟基、羰基和醚键,不可与NaOH反应,故错误; D.丹参醇含有两个羟基和羰基和碳碳双键和醚键,能发生加聚反应,能发生缩聚反应,故错误;故选AB。(4) 丹参醇与同分异构体中组成相同,由元素分析仪显示的信号完全相同,故选c。 (5) 芳香化合物F是A的同分异构体,分子式为C8H10O,可与氯化铁发生显色反应,说明苯环上连接羟基,所以该物质可能连接2个取代基,一个羟基和一个乙基,二者有邻间对三种位置关系,也可能为一个羟基和两个甲基,有6种结构,共9种。其中核磁共振氢谱有四组峰,峰面积我6:2:1:1的结构简式为
; (3) A.D→E的反应过程中羟基和邻位碳上的氢原子下去,形成碳碳双键,反应为消去反应,故正确;B.D中含有羟基,而E没有,所以可以用金属钠鉴别D.E,故正确;C.D含有羟基、羰基和醚键,不可与NaOH反应,故错误; D.丹参醇含有两个羟基和羰基和碳碳双键和醚键,能发生加聚反应,能发生缩聚反应,故错误;故选AB。(4) 丹参醇与同分异构体中组成相同,由元素分析仪显示的信号完全相同,故选c。 (5) 芳香化合物F是A的同分异构体,分子式为C8H10O,可与氯化铁发生显色反应,说明苯环上连接羟基,所以该物质可能连接2个取代基,一个羟基和一个乙基,二者有邻间对三种位置关系,也可能为一个羟基和两个甲基,有6种结构,共9种。其中核磁共振氢谱有四组峰,峰面积我6:2:1:1的结构简式为 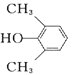 或
或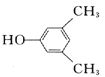 。(6) ,根据已知信息分析,二烯烃可以和烯烃发生加成反应生成环状,所以合成路线中需要将烯烃变成二烯烃,需要通过烯烃的加成和卤代烃的消去实现,所以合成路线为:
。(6) ,根据已知信息分析,二烯烃可以和烯烃发生加成反应生成环状,所以合成路线中需要将烯烃变成二烯烃,需要通过烯烃的加成和卤代烃的消去实现,所以合成路线为: 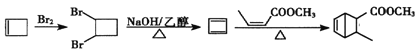 。
。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A. d>a>c>bB. b>c>d>aC. d>a>b>cD. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和1.01×105时,2N2O5(g)=4NO2(g)+O2(g) △H =+56.76kJ/mol ,该反应能自发进行的原因是
A.是吸热反应B.是放热反应
C.是熵减少的反应D.熵增大效应大于焓效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活中的物质与其有效成分的化学式、用途的对应关系中,不正确的是( )
选项 | A | B | C | D |
生活中的物质 | 84消毒液 | 小苏打 | 复方氢氧化铝片 | 食盐 |
有效成分的化学式 | Ca(OH)2 | NaHCO3 | Al(OH)3 | NaCl |
用途 | 做消毒剂 | 做发酵粉 | 做抗酸药 | 做调味品 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.Fe3+、Cu2+、Cl-、SO42-B.Fe2+、H+、Cl-、MnO4-
C.H+、ClO-、Cl-、SO42-D.K+、Fe3+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2![]() 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C![]() Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO![]() Pb+CO2。
Pb+CO2。
下列说法正确的是
A. 浮选法富集方铅矿的过程属于化学变化
B. 将1mol PbS冶炼成Pb理论上至少需要6g碳
C. 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
D. 整个冶炼过程中,制取1mol Pb共转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A+B―→C(放出能量)分两步进行:①A+B―→X(吸收能量),②X―→C(放出能量)。下列示意图中表示总反应过程中能量变化的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.氯气的性质很活泼,它与氢气混合后立即发生爆炸
B.实验室制取氯气时,为了防止污染环境,多余的氯气可以用氢氧化钙溶液吸收
C.新制氯水的漂白性强于久置氯水的漂白性
D.检验HCl气体中是否混有Cl2的方法是将气体通入硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一化学兴趣小组测得某品牌漂白粉〔CaCl2与Ca(ClO)2的混合物〕中Ca元素的质量分数为32.0%,则氧元素的质量分数为( )
A.56.8%B.36.4%C.11.2%D.45.6%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com