
| 实验序号 | I | II | III | IV |
| NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
| 样品质量(g) | 3.44 | m | 17.2 | 21.5 |
| NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
分析 发生反应有:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2NH3↑+2H2O、NH4NO3+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaNO3+NH3↑+H2O;由表可知,Ⅰ、Ⅱ氢氧化钠过量,而当生成氨气5.6L时,所需固体的质量为:$\frac{5.6}{1.12}×3.44$=17.2g,所以Ⅲ混合物与氢氧化钠恰好完全反应,IV是氢氧化钠不足,由此分析解答.
解答 解:发生反应有:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2NH3↑+2H2O、NH4NO3+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaNO3+NH3↑+H2O;由表可知,Ⅰ、Ⅱ氢氧化钠过量,而当生成氨气5.6L时,所需固体的质量为:$\frac{5.6}{1.12}×3.44$=17.2g,所以Ⅲ混合物与氢氧化钠恰好完全反应,IV是氢氧化钠不足,
(1)氢氧化钠过量时,生成气体的量与固体混合物成正比,所以m=$\frac{2.24}{1.12}×3.44$=6.88g,氢氧化钠的物质的量浓度可知根据Ⅲ、Ⅳ来求,由III两者恰好完全反应,可知:n(NaOH)=n(NH3)=$\frac{5.60}{22.4}$=0.25mol,所以c(NaOH)=$\frac{0.25mol}{0.05L}$=5mol•L-1,故答案为:6.88g;5.00;
(2)设NH4NO3的物质的量为xmol,(NH4)2SO4的物质的量为ymol,
所以$\left\{\begin{array}{l}{x+2y=\frac{5.6}{22.4}}\\{80g/mol×x+132/mol×y=17.2}\end{array}\right.$,解之得:$\left\{\begin{array}{l}{x=0.05}\\{y=0.1}\end{array}\right.$,样品中NH4NO3和(NH4)2SO4物质的量之比为1:2,故答案为:1:2.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:推断题
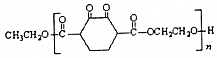 )是人造棉的主要成分之一,合成线路如图:
)是人造棉的主要成分之一,合成线路如图: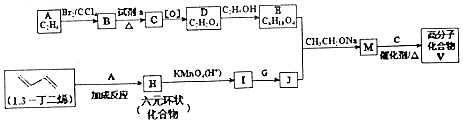
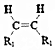 $\stackrel{KMnO_{4}/H+}{→}$2R1COOH
$\stackrel{KMnO_{4}/H+}{→}$2R1COOH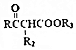 +R1OH
+R1OH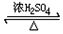 CH3CH2OOC-COOCH2CH3+2H2O.
CH3CH2OOC-COOCH2CH3+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 向浓度均为1×10-4 mol/L的KCl和K2CrO4混合液中逐滴加入1×10-3 mol/LAgNO3溶液,CrO42-先沉淀(10-5 mol/L是否太小?这个浓度一般都认为沉淀完全了) | |
| B. | H2CO3、HCO3-、CH3COO-、ClO-在溶液中可以大量共存 | |
| C. | 相同浓度的CH3COONa和NaClO混合溶液,各离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+) | |
| D. | 碳酸钠溶液中滴加少量氯水的离子方程式为:CO32-+Cl2+H2O═HCO3-+Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeCl3跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为NA | |
| B. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| C. | 6.8克熔融的KHSO4中含有0.1NA个阳离子 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
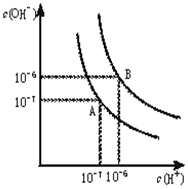 水的电离平衡曲线如下图所示.
水的电离平衡曲线如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
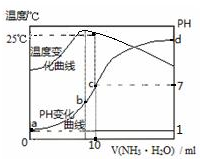
| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH4+)=c(Cl-)=1.0mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)=(n-1)×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图(夹持仪器略去),主要步骤如下:
无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图(夹持仪器略去),主要步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com