
| 实验步骤 | 预期现象和相应结论 | |
| i |  试管B中的试剂为澄清石灰水.向试管A中滴入盐酸. 试管B中的试剂为澄清石灰水.向试管A中滴入盐酸. |
①若 ②若 |
| ii | 若“假设一”不成立,向实验步骤i反应后的试管A中滴入2滴 |
①若 中的②分析,则“假设三”成立. ②若 |
 ;
; ,
, ;
;| 715V |
| 224 |
| 715V |
| 224 |
| 实验步骤 | 预期现象和结论 | |
| ① | 加入适量的1mol/L盐酸溶解后,将产生的气体通入足量的澄清石灰水中 | (1)若澄清石灰水未见浑浊,则假设一成立 (2)若澄清石灰水变浑浊,则假设二或三成立 |
| ② | 向步骤①反应后的试管滴入1~2滴品红溶液,振荡 | (1)若品红褪色,固体中存在 Ca(ClO)2,假设三成立;(2)若品红不褪色,则固体中不存在 Ca(ClO)2,假设二成立; |
| ③ | ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将Cu片放入浓H2SO4中 | 生成刺激性气味气体 | Cu与浓H2SO4反应生成SO2 |
| B | Al2(SO4)3溶液中滴加过量氨水 | 生成白色胶状物质 | Al(OH)3不溶于氨水 |
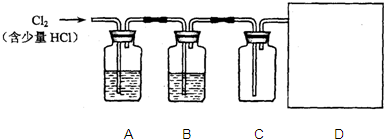
| C | 氯气通入湿润的红色布条 | 红色布条褪色 | 氯气具有漂白性 |
| D | 向某溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 该溶液中存在I- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol
一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:
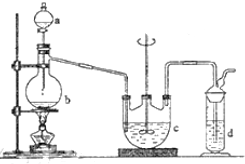 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
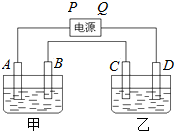 已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.
已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1-溴丙烷与2-溴丙烷发生消去反应的产物不相同 |
| B、苯、甲苯在一定条件下均能发生取代反应 |
| C、通过红外光谱分析可以区分CH3CH2OH和CH3OCH3 |
D、异戊二烯(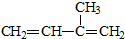 )与等物质的量的溴单质反应,产物只有一种 )与等物质的量的溴单质反应,产物只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com