
【题目】取一定质量的Cu,Cu2O,CuO的固体混合物,将其分成两等份.其中一份通入足量的氢气充分反应后固体质量为25.6g,另一份加入500mL稀硝酸中固体恰好完全溶解并产生标准状况下的NO气体4.48L.已知Cu2O+2H+═Cu+Cu2++H2O.则稀硝酸的浓度为( )
A.2 molL﹣1
B.1.6 molL﹣1
C.0.8 molL﹣1
D.0.4 molL﹣1
科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:
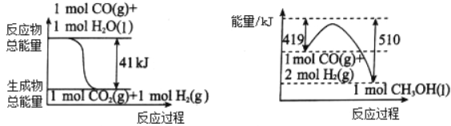
则CO2与H2反应生成CH3OH的热化学方程式为_____________________
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1>0
CO(g)+3H2(g) △H1>0
Ⅱ.CO(g)+2H2(g)![]() CH3OH(g) △H2<0
CH3OH(g) △H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如下图所示。
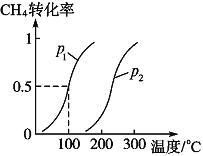
①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为________;
②图中的p1_______p2(填“<”、“>”或“=”),判断的理由是________________________。
③若反应Ⅱ在恒容密闭容器进行,下列能判断反应Ⅱ达到平衡状态的是_________(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol·L﹣1)变化如下表所示:
2min | 5min | 10min | |
CO | 0.07 | 0.06 | 0.05 |
H2 | 0.14 | 0.12 | 0.20 |
CH3OH | 0.03 | 0.04 | 0.05 |
若5min时只改变了某一条件,则所改变的条件是_____________;10min时测得各物质浓度如表,10min时v正_______v逆(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是
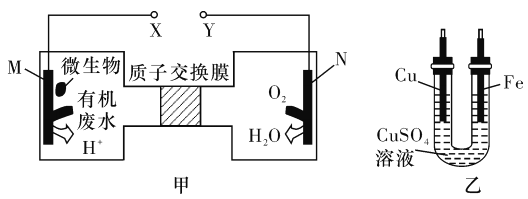
A. 铜电极应与X相连接
B. H+经过质子交换膜由右向左移动
C. 当N电极消耗0. 25 mol气体时,则铁电极增重16 g
D. M电极反应式:CO(NH2)2+H2O-6e- =CO2↑+N2↑+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A.木炭具有还原性,可用于冰箱除异味B.浓硫酸具有脱水性,可用于干燥气体
C.氢氧化铝具有弱碱性,可用于制作胃酸中和剂D.碳酸氢铵受热易分解,可用作化肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PBS是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经下列路线合成:
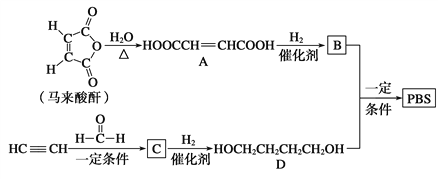
已知: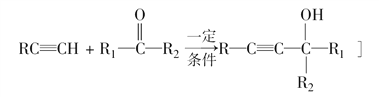
(1)A→B的反应类型是__________;B的结构简式是____________。
(2)C中含有的官能团名称是__________;D的名称(系统命名)是__________。
(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含—O—O—键,半方酸的结构简式是____________。
(4)由B和D合成PBS的化学方程式是__________________。
(5)下列关于A的说法正确的是________。
a.能使酸性KMnO4溶液或溴的CCl4溶液褪色
b.能与Na2CO3反应,但不与HBr反应
c.能与新制Cu(OH)2反应
d.1 mol A完全燃烧消耗5 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:
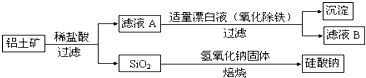
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________
②检验滤液B中是否还含有铁元素的方法为:_________________________
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________(填操作名称)、过滤、洗涤。
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________。
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加入Al能产生H2的溶液中一定能大量共存的是
A. K+、Na+、Br﹣、SO42- B. Na+、Ba2+、ClO﹣、Cl﹣
C. Ca2+、Cl﹣、HCO3-、K+ D. NH4+、K+、OH﹣、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com