
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
分析 ①可逆反应不能完全反应;
②根据n=$\frac{m}{M}$计算15g甲基(-CH3)的物质的量,每个甲基含有9个电子;
③根据n=$\frac{m}{M}$计算Cu的物质的量,阴极上铜离子获得电子转化为Cu,结合Cu元素化合价变化计算转移电子数目;
④浓硫酸变稀后不与Cu反应;
⑤12.4g白磷为0.1mol,P4分子含有6个P-P键;
⑥均由S原子形成,根据n=$\frac{m}{M}$计算硫原子的物质的量,再根据N=nNA计算;
⑦BaO2由钡离子与过氧根离子构成,0.1过氧化钡含有0.1mol钡离子、0.1mol过氧根离子.
解答 解:①可逆反应不能完全反应,反应后分子物质的量大于2mol,容器内物质分子数大于2NA,故错误;
②15g甲基(-CH3)的物质的量为1mol,每个甲基含有9个电子,含有电子数目为9NA,故错误;
③32g Cu的物质的量为0.5mol,阴极上铜离子获得电子转化为Cu,转移1mol电子,故转移电子数均为NA,故正确;
④随反应进行,硫酸消耗且有水生成,浓硫酸变稀后不与Cu反应,0.2molH2SO4的浓硫酸与足量铜反应,生成SO2小于0.1mol,其分子数小于0.1NA,故错误;
⑤12.4g白磷为0.1mol,P4分子含有6个P-P键,含有的P-P键数是0.6NA,故正确;
⑥均由S原子形成,硫原子的物质的量为$\frac{6.4g}{32g/mol}$=0.2mol,含硫原子总数为0.2NA,故正确;
⑦BaO2由钡离子与过氧根离子构成,0.1过氧化钡含有0.1mol钡离子、0.1mol过氧根离子,阴、阳离子总数为0.2NA,故正确,
所以③⑤⑥⑦正确,
故选C.
点评 本题考查物质的量有关计算,是对学生综合能力的考查,⑤中注意白磷的结构,难度中等.


科目:高中化学 来源: 题型:选择题
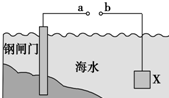
| A. | 当a、b间用导体连接时,则X应发生氧化反应 | |
| B. | 当a、b间用导体连接时,则X可以是锌或石墨 | |
| C. | 当a、b与外接电源相连时,a应连接电源的正极 | |
| D. | 当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e→Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.00 mol•L-1 NaCl溶液中含有Na+的数目为NA | |
| B. | 常温常压下,6.4 g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA | |
| D. | 在催化剂作用下,6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Fe2+):c(Fe3+)=3:1 | B. | c(Fe3+):c(Cu2+)=4:3 | ||
| C. | c(CI-)=6mol/L,c(Fe2+)=0.6mol/L | D. | 该绝缘板腐蚀后质量减少0.384g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硝酸亚铁溶液中加入稀硫酸 | |
| B. | 含有酚酞的碳酸钠溶液中加入足量的氧化钙溶液 | |
| C. | 硫酸铜溶液中滴加硝酸钡溶液 | |
| D. | 高锰酸钾酸性溶液中滴加亚硫酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2CO3 | Ka1=4.3×10-7 | HClO | Ka=2.95×10-8 |
| Ka2=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、坩埚、坩埚钳、酒精灯、三脚架 | 灼烧FeCl3固体 |
| B | 烧杯、玻璃棒、胶头滴管、漏斗、滤纸、带铁圈的铁架台 | 用NaOH溶液除去Fe粉中少量Al |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶、量筒 | 用10mol•L-1的硫酸配置0.1mol•L-1的硫酸 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 根据题中信息,可推断氨水显弱碱性 | |
| B. | 加水稀释过程中,c(H+)/c(OH-) 的值减小 | |
| C. | 与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+) | |
| D. | 加入少量NH4Cl 固体,溶液中水的电离平衡:H2O?H++OH-向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )
如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )| A. | ① | B. | ② | C. | ①② | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com