
 .
.
分析 (1)C元素,原子价层电子排布为ns2np2,故价电子轨道表达式为 ,据此进行分析;
,据此进行分析;
(2)计算C原子的价电子对数进行判断;具有相同原子数和价电子数的微粒互称为等电子体;
(3)正负电荷重心重合为非极性分子,正负电荷重心不重合为极性分子,结合分子空间构型判断,对于ABn型分子,中心原子A的最外层电子全部成键,为非极性分子,中心原子A的最外层电子部分成键,为极性分子,据此结合选项解答;
(4)离子晶体熔沸点与晶格能成正比,晶格能与离子比较成反比、与电荷成正比;
(5)氯化铁熔沸点较低,应为分子晶体;
(6)由图可知,a为面心立方最密堆积,b为体心立方最密堆积;利于均摊法计算a晶胞中Fe原子数目,表示出晶胞质量,Fe原子的半径为r pm,故晶胞棱长为$\frac{4r}{\sqrt{2}}$ pm,再根据ρ=$\frac{m}{V}$计算.
解答 解:(1)C元素,原子价层电子排布为ns2np2,故价电子轨道表达式为 ,
,
故答案为: ;
;
(2)CC14的价电子对数=$\frac{4+1×4}{2}$=4,形成四条杂化轨道,C原子的杂化方式为sp3;形成正四面体结构;具有相同原子数和价电子数的微粒互称为等电子体,所以与CC14互为等电子体的微粒有SO42-等;
故答案为:正四面体;sp3;SO42-;
(3)PH3结构为三角锥形,正负电荷的中心不重合,属于极性分子,
故答案为:极性;
(4)离子晶体熔沸点与晶格能成正比,晶格能与离子比较成反比、与电荷成正比,FeO和NiO相比,阴离子相同,阳离子所带电荷相同,但亚铁离子半径大于镍离子,所以FeO晶格能小,熔点低,
故答案为:<;FeO和NiO相比,阴离子相同,阳离子所带电荷相同,但亚铁离子半径大于镍离子,所以FeO晶格能小,熔点低;
(5)FeCl3的沸点:319℃,熔点:306℃,熔沸点较低,应属于分子晶体,
故答案为:分子晶体;
(6)由图可知,a为面心立方最密堆积,b为体心立方最密堆积,a晶胞中Fe原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为4×$\frac{56}{NA}$=$\frac{224}{NA}$g,Fe原子的半径为r pm,故晶胞棱长为$\frac{4r}{\sqrt{2}}$ pm,故晶体的密度ρ=$\frac{m}{V}$=$\frac{\frac{224}{{N}_{A}}}{(\frac{4r×1{0}^{-10}}{\sqrt{2}})^{3}}$=$\frac{224}{(\frac{4r×1{0}^{-10}}{\sqrt{2}})^{3}{N}_{A}}$g•cm-3,
故答案为:b;$\frac{224}{(\frac{4r×1{0}^{-10}}{\sqrt{2}})^{3}{N}_{A}}$.
点评 本题考查极性分子和非极性分子判断,分子的空间构型、晶体熔沸点高低判断以及晶体类型的判断,难点是晶胞计算,本题难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2CO3 | ⑦CO2 ⑧Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通氢气的一极是正极,通氧气的一极是负极 | |
| B. | 通氢气的一极发生的是还原反应 | |
| C. | 工作一段时间后电解质溶液的pH值减小 | |
| D. | 工作时负极区附近的pH值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成 | |
| B. | 香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应 | |
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 | |
| D. | 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
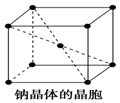 金属钠晶体为体心立方晶格(如图),实验测得钠的密度为ρ(g•cm-3).已知钠的相对原子质量为a,阿伏加德罗常数为NA(molC-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为( )
金属钠晶体为体心立方晶格(如图),实验测得钠的密度为ρ(g•cm-3).已知钠的相对原子质量为a,阿伏加德罗常数为NA(molC-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为( )| A. | $\root{3}{\frac{2a}{{N}_{A}ρ}}$ | B. | $\sqrt{2}$$\root{3}{\frac{2a}{{N}_{A}ρ}}$ | C. | $\frac{\sqrt{3}}{4}$$\root{3}{\frac{2a}{{N}_{A}ρ}}$ | D. | $\frac{1}{2}$$\root{3}{\frac{2a}{{N}_{A}ρ}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池中一定是相对较活泼的金属做负极不活泼的金属做正极 | |
| B. | 在原电池中,电子流出的一极是负极,该电极被还原 | |
| C. | 原电池可以把物质内部的能量全部转化为电能 | |
| D. | 实验室欲快速制取氢气,可利用粗锌与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄砷中共价键键能大于白磷 | B. | 黄砷的熔点高于白磷 | ||
| C. | 黄砷易溶于水 | D. | 分子中共价键键角均为109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有等物质的量的AlO2-,OH-,CO32-的溶液中逐滴加入盐酸:AlO2-,OH-,CO32- | |
| B. | 含有等物质的量的FeBr2和FeI2溶液中缓缓通入Cl2:I-,Br-,Fe2+ | |
| C. | 在等物质的量的Ba(OH)2和KOH溶液中缓缓通入CO2:KOH,Ba(OH)2,BaCO3 | |
| D. | 在含有等物质的量的Fe3+、Ag+、Cu2+、H+、Fe2+的溶液中逐渐加入锌粉:Ag+、Fe3+、Cu2+、H+、Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com