
【题目】为了测定铁铜合金的组成,将7.6g铁、铜合金加入100mL某浓度的稀硝酸中,待合金完全溶解后,共收集到NO气体2.24L(标准状况下),并测得溶液中H+的浓度为0.5molL﹣1 . 若反应前后溶液的体积变化忽略不计,则下列判断正确的是( )
A.上述反应中金属共失去电子0.1 mol
B.合金中,铜的质量为2.8 g
C.原硝酸的浓度:c(HNO3)=4.5 molL﹣1
D.要使溶液中的金属离子完全沉淀,需加5 molL﹣1的NaOH溶液60 mL
【答案】C
【解析】A.由分析可知,金属共失去电子0.3 mol,A不符合题意;
B.合金中,铜的质量为0.075mol×64=4.8 g,B不符合题意;
C.反应生成Cu(NO3)2、Fe(NO3)3和NO,以及剩余的硝酸,根据氮原子守恒可知,n(HNO3)=0.075×2+0.05×3+0.1+0.05=0.45mol,则c(HNO3)= ![]() =
= ![]() =4.5mol/L,C符合题意;
=4.5mol/L,C符合题意;
D.要使溶液中的金属离子完全沉淀,溶液中的溶质为NaNO3,n(NaNO3)=n(NaOH)=0.075×2+0.05×3+0.05=0.35mol,V= ![]() =
= ![]() =0.07L=70mL,D不符合题意;
=0.07L=70mL,D不符合题意;
故答案为:C
n(NO)= 2.24 L 22.4 L / m o l =0.1mol,则转移电子为0.1mol×(5﹣2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol。据此分析选项。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)是一种深红色固体,不溶于水和乙醇,100℃时发生分解。可由CuSO4·5H2O和SO2等为原料制备,实验装置如下图所示:

(1)装置A在常温下制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是_______________。
(2)装置B中发生反应的离子方程式为_______________。
(3)装置C的作用是____________________。
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。
①检验洗涤已完全的方法是__________________。
②不用烘干的方式得到产品,其原因是________________。
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O)的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,_______________,过滤,用95%酒精洗涤晶体2~3次,晾干,得到CuSO4·5H2O。
[已知:①该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2(5.8,8.8);Cu(OH)2(4.2,6.7);Fe(OH)3(1.1,3.2)。②在水溶液中超过100℃,硫酸铜晶体易失去结晶水。③硫酸铜晶体溶解度曲线如右图所示]

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伪麻黄碱(D)是新康泰克的成分之一,能够缓解感冒时带来的鼻塞、流鼻涕和打喷嚏等症状,其中一种合成路线如下:
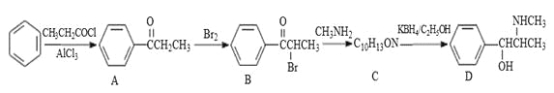
回答下列问题:
(1)伪麻黄碱(D)的分子式为 ;B中含有的官能团有 (写名称)。
(2)写出 B—C反应的化学方程式: 。C—D的反应类型为 。
(3)B的消去产物可以用于合成高分子化合物E,请写出 E的结构简式: 。
(4)满足下列要求的A的同分异构体有 种;
①能发生银镜反应
②苯环上的一氯代物有两种结构,其中核磁共振氢谱为4组峰,且峰面积之比为6:2:1:1的为 (写结构简式)。
(5)已知:![]() 。参照上述合成路线,设计一条由苯和乙酸为起始原料制备
。参照上述合成路线,设计一条由苯和乙酸为起始原料制备![]() 的合成路线: 。
的合成路线: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,在850℃时,平衡常数K=1.现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
(1)达平衡时,CO转化率为多少?
(2)H2的体积分数为多少?
(3)若温度仍为850℃,初始时CO浓度为2mol/L,H2O(g)为6mol/L,则平衡时CO转化率为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A (g) +B (g)=2C (g)若经2 s后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是
①用物质A表示的反应的平均速率为0.3 mol/ (Ls)
②用物质B表示的反应的平均速率为0.6 mol (Ls)
③反应达到平衡时,A、B、C的反应速率一定相等
④反应达到平衡时,A、B、C的物质的量均不再变化
A. ①③ B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治禽流感病毐目前人类面临的-个重大课题。八角茴香属于草本植物,是我国民间常用做烹调的香料。医学研究成果显示,从八角茴香中可提取到莽草酸. 莽草酸有抗炎, 镇痛作用,也是合成对禽流感病爯毒有一定抑制作用的—种药物“达菲”的前体。莽草酸的结构式如下图所示,下列关于莽草酸的说法正确的是

A. 莽草酸的分子式为C7H4O5
B. 莽草酸的分子之间可能发生酯化反应
C. 莽草酸中含有苯环
D. 莽草酸不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组比较不正确的是( )
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na,故K可以从NaCl溶液中置换出金属钠
C.金属性:K>Na>Li
D.碱金属元素原子最外层电子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用硫酸铝酸性溶液制备可溶性的碱式硫酸铝[Ala(SO4)b(OH)c],并用它对烟气进行脱硫处理的过程如图1: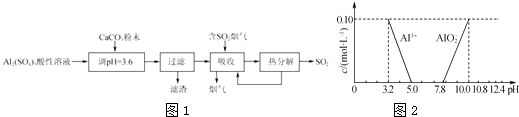
(1)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Ala(SO4)b(OH)c . 过滤时所用的玻璃仪器有、和烧杯,滤渣的主要成分为(填化学式).
(2)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将(填“增大”“减小”或“不变”).
(3)Ala(SO4)b(OH)c中a、b、c的代数关系式为 .
(4)已知在常温下溶液中Al3+、AlO2﹣的浓度与溶液pH的关系如图2所示.为确定碱式硫酸铝的组成,进行如下实验:
①取2.18g碱式硫酸铝样品在空气中灼烧至恒重,样品质量减少了0.36g.
②另取2.18g碱式硫酸铝溶于水,调节溶液的pH到5.0~7.8.
③将②产生的沉淀过滤、洗涤、灼烧至恒重,称量剩余固体为1.02g.
请计算样品中Al3+和SO42﹣的物质的量之比(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图均能表示甲烷的分子结构,按要求回答下列问题。


(1)甲烷的球棍模型是________,甲烷的电子式是__________ (填序号)。甲烷的空间构型是__________________。
(2)写出甲烷与氯气发生反应的化学方程式_____________(只写第一步),该反应的反应类型是________________。
(3)相对分子质量为72的烷烃的分子式是_______________。
(4)甲烷与丙烷互为______
A.同位素
B.同素异形体
C.同系物
D.同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com