
| A、水杨酸中毒应该静脉滴注碳酸钠溶液 | B、合成纤维、塑料、合成橡胶是常说的三大合成材料 | C、油脂是重要的体内能源,是人体不可缺少的营养物质 | D、以NaClO为有效成分的漂白液可以作为游泳池和环境的消毒剂 |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
| A、4.0 g重水(D20)中所含中子数为1.6 NA | B、1 L 2 mol?L-1K2S溶液中S2-和HS-的总数为2 NA | C、2.4g金刚石与石墨的混合物中所含碳原子数为0.2 NA | D、50 mL 18 mol?L-1浓硫酸与足量铜反应,转移的电子数为0.9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
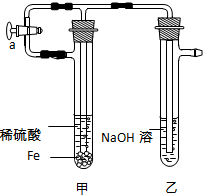 用下面的方法可以制得白色的Fe(OH)2沉淀.
用下面的方法可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:
 HArF是第一个被发现的氩化合物,其分子的比例模型如图所示,在HArF中氟为-1价,氩为0价,其水溶液显强酸性,酸性与盐酸相当.下列有关说法错误的是( )
HArF是第一个被发现的氩化合物,其分子的比例模型如图所示,在HArF中氟为-1价,氩为0价,其水溶液显强酸性,酸性与盐酸相当.下列有关说法错误的是( )| A、稀有气体在一定条件下也可发生化学反应 | B、HAlF为极性分子 | C、ArF-具有较强的氧化性 | D、向HArF溶液中加入NaOH,反应的离子方程式为:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质硅用于制造芯片和光导纤维 | B、浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性 | C、SO2 具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 | D、30%的H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、①③④ | C、②④⑤ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蔬菜表面洒少许福尔马林,可保鲜和消毒 | B、绿色食品就是不使用化肥农药,不含任何化学物质的食品 | C、推广纳米TiO2光触媒技术铺设“生态马路”,将汽车尾气转化为无害物质 | D、推广使用煤液化技术可减少二氧化碳温室气体气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
| 2 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com