
| A. | 增大压强或降低温度,平衡常数K都增大 | |
| B. | 其它条件相同,向容器中只加入2molZ,能建立完全相同的平衡状态 | |
| C. | 平衡时,平衡常数K=36a(mol/L)-1 | |
| D. | 某时刻X、Y、Z物质的量分别是0.3mol,1mol和1.1mol,反应正向进行 |
分析 A.反应为放热反应,降低温度平衡正向进行,平衡常数只随温度变化;
B.其它条件相同,向容器中只加入2molZ,相当于加入1mol X气体和2mol Y气体;
C.结合三行计算劣势计算平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
D.计算此时浓度商和平衡常数比较来判断反应进行的方向.
解答 解:A平衡常数只随温度变化,.增大压强平衡正向进行,平衡常数不变,反应为放热反应,降低温度平衡正向进行,平衡常数增大,故A错误;
B.其它条件相同,向容器中只加入2molZ,相当于加入1mol X气体和2mol Y气体,能建立完全相同的平衡状态,故B正确;
C. X(g)+2Y(g)?2Z(g)
起始量(mol) 1 2 0
变化量(mol/L) 0.75 1.5 1.5
平衡量(mol/L) 0.25 0.5 1.5
K=$\frac{(\frac{1.5}{a})^{2}}{\frac{0.25}{a}×(\frac{0.5}{a})^{2}}$=36a(mol/L)-1,故C正确;
D.某时刻X、Y、Z物质的量分别是0.3mol,1mol和1.1mol,Qc=$\frac{(\frac{1.1}{a})^{2}}{\frac{0.3}{a}×(\frac{1}{a})^{2}}$=4.03a<K=36a,反应正向进行,故D正确;
故选A.
点评 本题考查了化学平衡影响因素、平衡常数计算和影响因素分析、反应进行方向判断等知识点,掌握基础是解题关键,题目难度中等.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
某同学组装了如图所示的电化学装置,其中电极I为Al,其它均为Cu,下列说法正确的是( )

A.装Al2(SO4)3 溶液的烧杯是原电池,其余两个为电解(电镀)池
B.盐桥中电子从右侧流向左侧
C.电极II逐渐溶解
D.电极IV的电极反应:Cu2+ + 2e- = Cu
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融NaHSO4电离出的阳离子与阴离子之比 | |
| B. | 0.2mol•L-1的CH3COOH溶液与0.1mol•L-1的盐酸中c(H+)之比 | |
| C. | pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 | |
| D. | pH=12的Ba(OH)2溶液与pH=12的KOH溶液中c(OH-)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 能发生加聚反应 | |
| B. | 能与碳酸钠溶液反应 | |
| C. | 1 mol咖啡酸最多能与3 mol NaOH反应 | |
| D. | 1 mol咖啡酸最多能与 3 mol Br2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
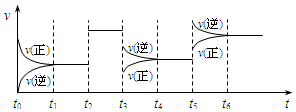 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时升高了温度 | D. | t4~t5时间内转化率一定最低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com