
| A、电化学腐蚀要比化学腐蚀普遍的多,但腐蚀速度要比化学腐蚀慢得多 |
| B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C、海轮外壳连接锌块是采用牺牲阳极的阴极保护法保护外壳不受腐蚀 |
| D、地下输油钢管与外加直流电源的正极相连可保护其不受腐蚀 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鼓励市民乘公交车,少开私家车 |
| B、鼓励游客使用聚乙烯塑料餐盒和一次性筷子 |
| C、利用地下水循环系统保持博鳌会场馆温度 |
| D、利用风能和太阳能发电照明旅游景点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、溶液酸性从大到小顺序为CH3COOH、H2CO3、HCN |
| B、碳酸电离方程式为H2CO3?2H++CO32- |
| C、25℃时,pH=5的CH3COOH溶液和pH=5的HCN 溶液中,后者浓度大 |
| D、温度相同时,相同浓度的NaHCO3和Na2CO3溶液的碱性,后者强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、放电时,Na 作正极,S极发生还原反应 |
| B、充电时,阳极发生的反应为:Sx2--2e-=xS |
| C、当用该电池电解AgNO3溶液时,阳极上产生标准状况下气体11.2L时,消耗金属钠23g |
| D、充电时钠极与外电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na++e--=Na |
| B、2H++4e-=2H2 |
| C、2Cl--2e-=Cl2 |
| D、4OH--4e-=2H2O+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、循环过程中需补充H2O |
| B、反应I中SO2氧化性比HI强 |
| C、反应III易在常温下进行 |
| D、循环过程中产生1molO2的同时产生1 molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:


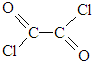 )与足量有机物D反应的化学方程式
)与足量有机物D反应的化学方程式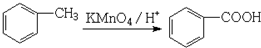

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com