
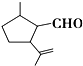
 有机物A是一种重要的化工原料,其结构简式如图,下列检验A中官能团的试剂和顺序正确的是( )
有机物A是一种重要的化工原料,其结构简式如图,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加KMnO4酸性溶液,再加银氨溶液,微热 | |
| B. | 先加溴水,再加KMnO4酸性溶液 | |
| C. | 先加银氨溶液,微热,再加溴水 | |
| D. | 先加入足量的新制Cu(OH)2悬浊液,微热,酸化后再加溴水 |
分析 有机物A的结构简式为 ,既有-CHO,又含有C=C双键,均能被氧化,应先利用弱氧化剂检验-CHO,再检验C=C双键,以此来解答.
,既有-CHO,又含有C=C双键,均能被氧化,应先利用弱氧化剂检验-CHO,再检验C=C双键,以此来解答.
解答 解:A.酸性高锰酸钾将C=C及-CHO均氧化,不能一一检验,故A错误;
B.溴水的氧化性很强,会把-CHO氧化成-COOH,同时C=C与溴水发生加成,不能一一检验,故B错误;
C.在既有C=C又有-CHO的情况下,银氨溶液(水浴)可检验-CHO,应该酸化后再加入溴水检验C=C双键,故C错误;
D.在既有C=C又有-CHO的情况下,可用新制氢氧化铜(加热至沸腾),检验-CHO,再利用溴水检验C=C,故D正确;
故选:D.
点评 本题考查有机物官能团的检验,题目难度不大,注意在既有C=C又有-CHO的情况下,明确检验的顺序是解答本题的关键.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 | |
| B. | 钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀可能会同时发生 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,其他条件不变时升高温度,反应速率v (H2)和氢气的平衡转化率均增大 | |
| D. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | Ka(HF) | C. | $\frac{{F}^{-}}{C({H}^{+})}$ | D. | $\frac{({F}^{-})}{C(HF)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-n-2}{w•m}$mol | B. | $\frac{w(m-n)}{n}$mol | C. | $\frac{w}{n}$(m-n-2)mol | D. | $\frac{w}{m}$(m-n+2)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 22.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CN)2和NaOH溶液反应:(CN)2+2OH-═CN-+CNO-+H2O | |
| B. | MnO2和HCN反应:MnO2+4HCN═Mn(CN)2+(CN)2↑+2H2O | |
| C. | 向KCN溶液中加入碘水:I2+2KCN═2KI+(CN)2 | |
| D. | 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-═2Cl-+(CN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | Ba(OH)2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com