
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
分析 (1)①依据图标数据分析,平衡常数随温度升高减小,平衡逆向进行说明反应是放热反应;
②勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用;
(2)根据热化学方程式的书写方法以及热化学方程式的意义来回答;
(3)根据电荷守恒,溶液中c(NH+4)=c(Cl-),所以溶液中氢离子和氢氧根离子浓度都是10-7mol/L,根据氯离子浓度计算c(NH4+),利用物料守恒计算溶液中c(NH3.H2O),代入NH3•H2O的电离常数表达式计算;
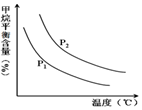
(4)①依据图象变化分析,相同温度下,CH4(g)+H2O (g)═CO(g)+3H2(g),反应是气体体积增大的反应,压强越大,平衡逆向进行,甲烷平衡含量越高;
②压强一定,温度升高,甲烷平衡含量减小,平衡正向进行,依据平衡移动原理分析判断;
(5)①依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
②化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项.
解答 解:(1)①图表中平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应,放热;
②a.增大压强,合成氨反应向着气体的系数和减小的方向进行,有利于合成氨,可以用平衡移动原理解释,故正确;
b.使用合适的催化剂只能加快反应速率,但是不会引起平衡的移动,不可以用平衡移动原理解释,故错误;
c.合成氨反应是放热的,升高温度,反应逆向移动,生产中需要升高温度至500°C左右是为了加快反应速率,提高催化活性,不可以用平衡移动原理解释,故错误;
d.使用过量的N2,合成氨反应正向移动,可以提高H2转化率,可以用平衡移动原理解释,故正确;
故选:ad;
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,则1mol氨气溶于水后再与含有硫酸的溶液反应放热5QkJ,即NH3.H2O(aq)+H2SO4(aq)=NH4HSO4(aq)+H2O(l)△H=-5Q kJ•mol-1,故答案为:NH3.H2O(aq)+H2SO4(aq)=NH4HSO4(aq)+H2O(l)△H=-5Q kJ•mol-1;
(3)根据电荷守恒,溶液中c(NH+4)=c(Cl-),故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=0.5×bmol•L-1,故混合后溶液中c(NH3.H2O)=0.5×amol•L-1-0.5bmol•L-1=(0.5a-0.5b)mol/L,NH3•H2O的电离常数Kb=$\frac{1{0}^{-7}×0.5b}{0.5a-0.5b}$=$\frac{1{0}^{-7}b}{a-b}$,故答案为:$\frac{1{0}^{-7}b}{a-b}$;
(4)①依据图象变化分析,相同温度下,CH4(g)+H2O (g)═CO(g)+3H2(g),反应是气体体积增大的反应,压强越大,平衡逆向进行,甲烷平衡含量越高,所以P2>P1;故答案为:<;
②压强一定,温度升高,甲烷平衡含量减小,平衡正向进行,反应是吸热的,条件一定,升高温度,氢气的产率会增大,故答案为:增大;
(5)①依据化学平衡三段式列式计算平衡浓度,℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,
CO(g)+H2O(g)═CO2 (g)+H2(g)
起始量(mol/L) 0.2 0.2 0 0
变化量(mol/L) 0.12 0.12 0.12 0.12
平衡量(mol/L) 0.08 0.08 0.12 0.12
则该温度下反应的平衡常数K=$\frac{0.12×0.12}{0.08×0.08}$=2.25;
故答案为:2.25;
②化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项,CO(g)+H2O(g)═CO2 (g)+H2(g),反应是气体体积不变反应;
a.反应过程中和平衡状态下压强相同,容器内压强不随时间改变,不能说明反应达到平衡状态,故a不符合;
b.混合气体质量守恒,反应前后气体体积不变,反应过程中和平衡状态下,混合气体的密度不随时间改变,不能说明反应达到平衡状态,故b不符合;
c.单位时间内生成amolCO2的同时消耗amolH2,说明二氧化碳或氢气的正逆反应速率相同,说明反应达到平衡状态,故c符合;
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6,依据反应前后气体物质的量相同,可以利用物质的量代替浓度计算浓度商和平衡常数比较,
Q=$\frac{6×6}{1×16}$=2.25=K,说明反应达到平衡状态,故d符合;
故答案为:cd.
点评 本题考查了化学平衡影响因素,平衡标志分析,平衡常数的计算应用,主要是图象分析判断,平衡移动原理的理解应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH- )=c(CH3COO-)-c(CH3COOH) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+ )>c(OH? )=c(H+) | |
| D. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl- )+c(ClO- )+c(OH? ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
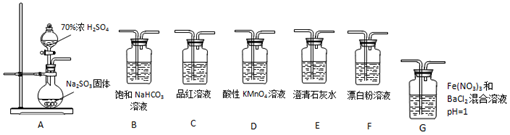
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
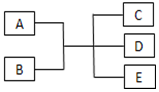 已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如图反应关系.
已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如图反应关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “人造太阳”实验发生的反应:${\;}_{1}^{2}$H+${\;}_{1}^{3}$H→${\;}_{2}^{4}$He+${\;}_{0}^{1}$n,属于化学反应 | |
| B. | 长征5号推进剂液氧一煤油比长征2号推进剂N2O4-(CH3)2NNH2更环保 | |
| C. | 在某催化剂表面CO2与H2O可合成乙醇并生成O2,该反应属于放热反应 | |
| D. | 包裹聚氨酯海绵的蚕在太空成功结茧,聚氨酯海绵和蚕丝均属于天然高分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准情况下,22.4LH2O含有的分子数为NA | |
| B. | 1L 0.1 mol?L-1的MgCl2溶液中含Mg2+的数目为0.1NA | |
| C. | 17.6g丙烷中所含的共价键数目为4NA | |
| D. | 20 ml 2mol?L-1 H2O2完全分解,转移的电子数为0.08NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体中阴离子的个数为2NA | |
| B. | Na2O2与H2O反应生成1.12L(标准状况)气体,反应中转移的电子数为0.2NA | |
| C. | 1mol氯气溶于足量水中,转移的电子数为NA | |
| D. | 在1 L0.1mol/L碳酸钠溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 107 g Fe(OH)3胶体中胶体粒子的数目为NA | |
| B. | 2molSO2与1molO2反应生成的SO3分子数为2NA | |
| C. | 14g分子式为CnH2n的链烃中含有的碳碳双键的数目为$\frac{{N}_{A}}{n}$ | |
| D. | 7.8 g Na2O2与足量水反应转移的电子散为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com