
| A. | 2H2+O2═2H2O△H=-571.6 kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g )△H=-285.8kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ/mol |
分析 25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则4g氢气燃烧生成液态水,放出571.6kJ热量,热化学方程式应为2H2(g)+O2(g)═2H2O(1)△H=-571.6 kJ•mol-1,以此解答该题.
解答 解:4g氢气燃烧生成液态水,放出571.6kJ热量,
A、同时物质聚集状态未标注,故A错误;
B、2g氢气燃烧生成液态水,放出热量285.8kJ,但给定的不是液态水而是气态水,故不等于285.8kJ,故B错误;
C、4g氢气燃烧生成液态水,放出571.6kJ热量,放热时焓变值为负值,物质聚集状态标注,故C正确;
D、4g氢气燃烧生成液态水,放出热量571.6kJ,放热时焓变值为负值,故D错误;
故选C.
点评 本题主要考查热化学方程式的书写方法及系数的含义,注意焓变的正负和物质的状态.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学反应限度时,可生成2mol NH3 | |
| B. | 向容器中再加入N2,可以加快反应速率 | |
| C. | 降低温度可以加快反应速率 | |
| D. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶性:乙醇>新戊烷>苯酚 | |
| B. | 同质量的物质燃烧消耗O2量:乙烷>甲烷>乙炔 | |
| C. | 密度:水>苯>硝基苯 | |
| D. | 沸点:正戊烷>异戊烷>新戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
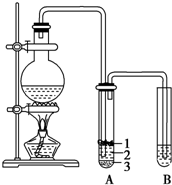 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com