
| A、1:4 | B、3:4 |
| C、4:1 | D、4:3 |
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
| A、同温同压下,相同体积的物质,其物质的量一定相等 |
| B、1升一氧化碳气体一定比1升氯气的质量小 |
| C、任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
| D、等体积、等物质的量浓度的强碱中所含的氢氧根离子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇的结构简式:C2H6O |
| B、Cl-的电子排布式:1s22s22p63s23p6 |
C、硫离子的结构示意图: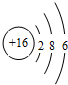 |
| D、氯化钠的分子式:NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl溶液、BaS04 |
| B、铜、二氧化硫 |
| C、NaCl晶体、酒精 |
| D、熔融的KNO3、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向血红色的Fe(SCN)3溶液中加入少量KSCN固体,溶液颜色加深 |
| B、合成氨工业中选择较大压强和较高温度以提高NH3的产率 |
| C、向水中加入酸或碱均会抑制水的电离 |
| D、浓氯化铵溶液可以溶解Mg(OH)2浊夜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体密度不再发生变化 |
| B、A、B的物质的量浓度之比等于1:2 |
| C、容器内总压强不再改变 |
| D、单位时间内消耗n mol A,同时消耗2n mol B |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com