
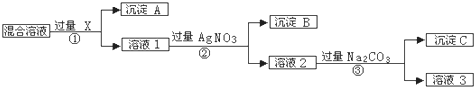


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
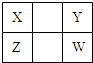 已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是( )
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是( )| A、Z元素的原子半径可能比Y元素的小 |
| B、Z的原子序数不可能是X的原子序数的2倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、Z的最高价氧化物的水化物的酸性一定比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在新制的氯水中加入NaOH溶液至中性时,满足c(Na+)=c(ClO-)+c(HClO) |
| B、25℃时,稀释0.5 mol?L-1的NH4Cl溶液,水解平衡右移,水解平衡常数Kh增大,而Kw不变 |
| C、常温下,pH=11的某碱MOH溶液与pH=3的盐酸等体积混合后,溶液可能呈中性或酸性 |
| D、0.2mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合,则:2c(H+)-2c(OH)=C(CH3COO)-C(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COOH)与c(CH3COO-)之和始终保持不变 | ||||
| B、当加入氨水的体积为10 mL时c(NH4+)=c(CH3COO-) | ||||
| C、水的电离程度始终增大 | ||||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com