
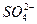 。
。 CH3COO-+H+。
CH3COO-+H+。 H++CH3COO-。当c(H+)减小时,CH3COOH的电离平衡向右移动,使H+不断产生。反应产生的H2体积变大。故c>a=b。
H++CH3COO-。当c(H+)减小时,CH3COOH的电离平衡向右移动,使H+不断产生。反应产生的H2体积变大。故c>a=b。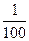 ,CH3COOH部分电离,随着水的加入,使CH3COOH的电离程度增大,c(H+)减小的程度较小,故c>a=b。
,CH3COOH部分电离,随着水的加入,使CH3COOH的电离程度增大,c(H+)减小的程度较小,故c>a=b。

科目:高中化学 来源:不详 题型:单选题
| A.n>m | B.n<m | C.n="m" | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.亚硫酸钠与盐酸反应:Na2SO3+2H+===2Na2++SO2↑+ H2O |
| B.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
| C.稀硫酸与锌反应:H2SO4+Zn=Zn2+ +SO42-+H2↑ |
| D.硫酸溶液与氢氧化钠溶液反应:H++ OH-==H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(1)(2)(3)(5) | B.(1)(3)(5) | C.(2)(3)(6) | D.(1)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
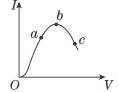
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 )的等式: 。
)的等式: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol·L-1的甲酸溶液的pH约为2 |
| B.甲酸能与水以任意比例互溶 |
| C.甲酸能使紫色石蕊试液变红 |
| D.在相同条件下,甲酸溶液的导电性比盐酸溶液的导电性弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.强酸、强碱及大部分盐类属于强电解质,弱酸、弱碱属于弱电解质 ? | B.所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质 ? | C.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 ? | D.SO2的水溶液能导电,所以SO2是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com