
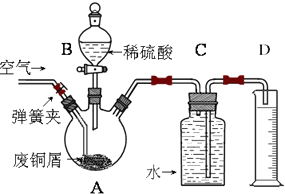
 一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.分析 (1)A中的废铜屑含有铁加入稀硫酸反应生成氢气,装置C是排水量气装置;
(2)①拆除C、D装置后,打开弹簧夹,持续将空气通入A中,至A中固体全部消失,再继续通入一段时间空气后,关闭弹簧夹,停止通入空气;
②依据酸性环境下氧气能够氧化二价铁离子生成三价铁离子,三价铁离子能够与铜反应生成铜离子与二价铁离子;
③加快A中的固体溶解速率增大,可以依据影响反应速率的因素分析;
(3)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,依据反应现象和反应物和产物分析书写离子方程式;
(4)测定沉淀质量计算铁元素质量来计算得到铜的质量分数.
解答 解:(1)A中的废铜屑含有铁加入稀硫酸反应生成氢气,装置C是排水量气装置,现象是C中液面下降,水被排到D中;
故答案为:水面下降,水顺长导管排入D中;
(2)①拆除C、D装置后,为了使A中固体全部消失,打开弹簧夹,持续将空气通入A中;
故答案为:打开弹簧夹,持续将空气通入A中;
②拆除C、D装置后,打开弹簧夹,持续将空气通入A中,生成的亚铁离子被空气中 的氧气氧化为铁离子,离子方程式:4Fe2++O2+4H+=4Fe3++2H2O,铁离子和铜反应生成亚铁离子,离子方程式:2Fe3++Cu=2Fe2++Cu2+;
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;2Fe3++Cu=2Fe2++Cu2+;
③为使A中固体加快溶解速率,
a.对A装置加热,温度升高会加快反应速率,故a正确;
b.向A内加入少量Fe2O3,溶解后自动铁离子浓度会提高溶解铜的反应速率,故b正确;
c.向A内加入少量CuO,和硫酸反应不能加快溶解速率,故c错误;
d.增大空气通入量,自动氧气浓度可以提高反应速率,故d正确;
e.向A内加入少量FeSO4,增大了亚铁离子浓度能加快反应速率,故e正确;
f.向A内加入少量H2O,稀释溶液浓度,反应速率减小,故f错误;
故选abde;
(3)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,此过程离子反应方程式是:Cu2(OH)2CO3+H++Fe3+=2Cu2++Fe(OH)3↓+CO2↑,
故答案为:Cu2(OH)2CO3+H++Fe3+=2Cu2++Fe(OH)3↓+CO2↑;
(4)不用测量气体法,可以依据沉淀方法,测定沉淀氢氧化铁质量,计算铁元素质量,得到铜的质量,计算废铜屑中铜的质量百分含量,沉淀实验方法为:将得到的氢氧化铁沉淀洗涤、干燥、称量、计算,
故答案为:将(4)中所得红褐色沉淀洗涤、干燥、称量、计算.
点评 本题为实验题,考查了物质性质的探究实验方法和实验设计,熟悉物质的性质是解题关键,注意影响反应速率因素,题目难度中等.


科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
现有H2S、NH3、CH4三种气体,它们分别都含有相同数目的氢原子,则三种气体的物质的量之比为( )
A. 1∶1∶1 B.2∶3∶4 C.6∶4∶3 D.6∶3∶4
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中只存在极性键 | B. | 在氰气中N、C的化合价为0 | ||
| C. | CN的电子式: | D. | 能与烯烃发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在0.1mol•L-1Na2C2O4溶液中:2c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4) | |
| B. | 向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| D. | 浓度均为0.1 mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
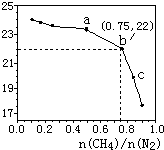 已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )
已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )| A. | n(CH4)/n(N2)越大,CH4的转化率越高 | |
| B. | a点对应的平衡常数比c点的大 | |
| C. | b点对应的NH3的体积分数为26% | |
| D. | 不改变投料比,增加n(N2)时,NH3体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 十五种 | B. | 十六种 | C. | 十七种 | D. | 十八种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 对羟基扁桃酸可以发生消去反应、取代反应和缩聚反应 | |
| B. | 苯酚和对羟基扁桃酸是同系物 | |
| C. | 乙醛酸与H2在热的镍催化下反应生成乙二醇 | |
| D. | 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | Y | |||
| Z | W | Q |
| A. | X、Y、W三种元素最低价氢化物的沸点依次升高 | |
| B. | 原子半径:Q>W>Z>Y>X | |
| C. | 最高价氧化物对应水化物的酸性:Q>W>Z | |
| D. | X及Q的气态氢化物相反应,形成的化合物为离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com