
【题目】近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
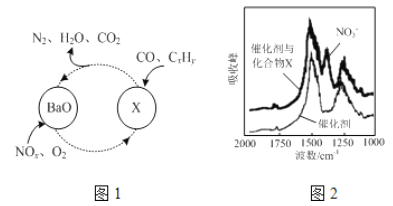
①在图示的转化中,被还原的元素是_______________,X的化学式为__________________。
②钡元素在周期表中的位置是___________________________。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的最之比为2:1时,写出发生反应的化学方程式:____________________________。
(3)利用ClO2氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2反应I的化学方程式是2NO+ ClO2+H2O==NO2+HNO3+ 2HCl,反应II的离子方程式是__________________。
N2反应I的化学方程式是2NO+ ClO2+H2O==NO2+HNO3+ 2HCl,反应II的离子方程式是__________________。
(4)加入过量次氯酸钠可使废水中NH4+完全转化为N2,而本身被还原为NaCl。
①检验废水中是否存在NH4+的方法是_______________________________________________。
②若处理废水产生了0.448LN2 (标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为____mL。
【答案】 N、O Ba(NO3)2 第六周期第 IIA 族 16NH3+12NO+6NO2=17N2+24H2O 2NO2+4SO32-=N2+4SO42- 少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口,若试紙变蓝,则A中生成NH4+ 30
【解析】(1) ①在图示的转化中N、O的化合价降低被还原;由傅里叶红外光谱图(如图2所示)确定化合物X含有硝酸根,在结合图1有钡离子参加,所以X的化学式为Ba(NO3)2;
②钡元素在周期表中的位置是第六周期第 IIA 族;
(2)因为NOx与NH3直接反应,实现无害转化,则生成氮气和水,所以当NO与NO2的物质的最之比为2:1时,发生反应的化学方程式为16NH3+12NO+6NO2=17N2+24H2O;因此,本题正确答案为:16NH3+12NO+6NO2=17N2+24H2O;
(3)二氧化氮具有氧化性,亚硫酸钠具有还原性,二者会发生氧化还原反应,因此,反应II的离子方程式是2NO2+4SO32-=N2+4SO42-;
(4)①检验NH4+的方法是:取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口,若试紙变蓝,则A中生成NH4+;
②因为次氯酸钠氧化废水中NH4+完全转化为N2,而本身被还原为NaCl,根据得失电子守恒,离子方程式:2NH4++3ClO-=N2↑+3Cl-+2H++3H2O 由2NH4++3ClO-=N2↑+3Cl-+2H++3H2O
知处理废水产生了0.448L氮气,即![]() =0.02mol,则需消耗浓度为2mol/L的次氯酸钠的体积为
=0.02mol,则需消耗浓度为2mol/L的次氯酸钠的体积为![]() ×1000mL=30mL;因此,本题正确答案为:30
×1000mL=30mL;因此,本题正确答案为:30


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】化学探究小组设计实验探究某种氮的化合物的制备及性质。
【探究一】下图A为某气体制备装置,图中未画出。
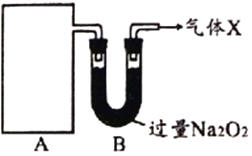
据此回答:
(1)①只用一种试剂制备A中某气体,选取的试剂是____________。
a.NH4HCO3 b.NH4Cl c.Ca(OH)2 d.NH4NO3
②装置A所用的主要玻璃仪器是____________(填仪器名称)。
(2)从装置A进入装置B的物质在B中被充分吸收,写出B中发生反应的化学方程式_______________________________(写出一个即可)。
【探究二】为探究上述装置中产生的气体性质,该化学探究小组又组装了如下装置,其中C处硬质试管中装有红色粉末铜粉。
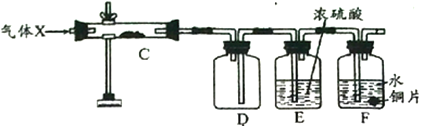
用酒精灯加热C处硬质试管一段时间后,再通入上述实验产生的气体,过一会撤去C处酒精灯。
据此回答:
(3)若实验过程中发现F处铜片逐渐溶解。则:
①D中观察到的现象是________________________________。
②C中发生反应的化学方程式为________________________________。
③F处铜片逐渐溶解的原因是________________________________。
④该装置的不足之处是________________________________。
(4)若实验过程中F处铜片没有任何变化,D中无任何现象发生,只观察到C中粉末在红色和黑色间交替变化。则C中发生反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
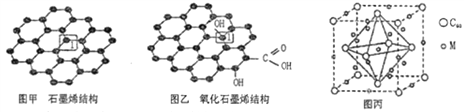
(1)图甲中,1号C与相邻C形成σ键的个数为__________。
(2)图乙中,1号C的杂化方式是__________,该C与相邻C形成的键角__________(填“>”、“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为____________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
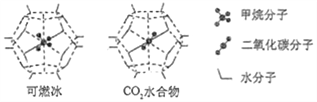
①“可燃冰”中分子间存在的2种作用力是___________________________;
②为开采深海海底的“可燃冰",有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想的依据是:___________________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 铁跟稀硫酸反应:2Fe + 6H+ ===2Fe3+ + 3H2 ↑
B. 盐酸与澄清石灰水反应:H+ + OH===H2O
C. 氯化铝溶液与过量氨水反应:Al3++3OH-=Al(OH)3↓
D. 二氧化碳通入足量的氢氧化钠溶液:CO2 + OH===![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应.如:2Al+Fe2O3![]() 2Fe+Al2O3,反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
2Fe+Al2O3,反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
(1)“铝热反应”属于四大基本反应类型中的________反应.
(2)信息中的“某些”反应指________(填“比铝活泼的”、“比铝稳定的”或“任意”)金属.
(3)试写出铝粉与MnO2发生的铝热反应方程式________________________________.
(4)题给的铝热反应可用于野外焊接钢轨,试说明其原因:_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”。当电解质中某离子的浓度越大时其氧化性或还原性越强。如图,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K2,断开K1,发现电流计指针发生偏转。下列说法不正确的是

A. 一段时间后电流计指针将归零,此时可视为反应不再进行
B. 当电流计指针归零后,闭合K1,断开K2后,乙池溶液浓度上升
C. 当电流计指针归零后,闭合K1,断开K2后,乙中Ag电极质量增加
D. 实验开始先闭合K2,断开K1,此时NO3-向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列盐既能发生水解反应,蒸干该盐溶液并充分加热后又能得到该盐(加热体系)的是
A. Na2CO3 B. AlCl3 C. NaCl D. NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铜、氯化亚铜是重要的化工原料,广泛用作有机合成的催化剂。
Ⅰ.实验室用右图所示装置,利用还原铜粉和氯气来制备氧化铜。
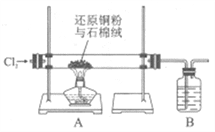
(1)石棉绒的作用是_______________。
(2)装置B中的试剂是_______________。
(3)所得产品中CuCl2的质量分数为90%,则其中可能含有的杂质是_______________(写一种即可)。
Ⅱ.另取纯净CuCl2固体用于制备CuCl。
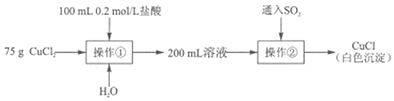
(4)操作①中加入盐酸的目的主要是_______________。
(5)操作②中反应的离子方程式为_______________。
(6)操作①中若用10mol/L盐酸代替0.2mol/L盐酸,再通入SO2后,无白色沉淀产生。对此现象有如下两种猜想:
猜想一:c(H+)过大导致白色沉淀溶解。
为验证此猜想,取75gCuCl2固体、100mL0.2mol/L盐酸及_______________mL9.8mol/LH2SO4配制成200mL溶液,再进行操作②,观察是否有白色沉淀产生。
猜想二:c(Cl-)过大导致白色沉淀溶解。
[资料显示:存在平衡2Cl-(aq)+CuCl(s)![]() CuCl32-(aq)]
CuCl32-(aq)]
请设计实验说明该猜想是否成立:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com